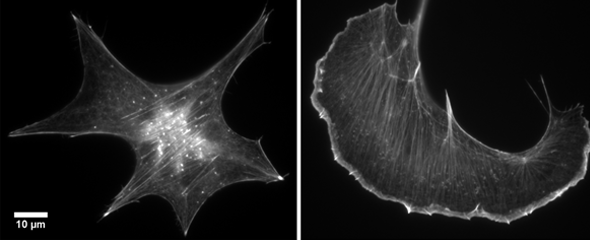
Ein Hauptbestandteil unserer Muskeln sind gewundene Stränge des Proteins Aktin. Sie sind wichtig für deren Kontraktion. Weniger bekannt ist, dass diese Proteinstränge, Aktinfilamente genannt, sich zu Netzwerken und Bündeln zusammenlagern und damit das Skelett jeder einzelnen Körperzelle bilden. Sie stabilisieren die Zelle, machen sie beweglich und ermöglichen Transportvorgänge im Zellinneren. Dass Zellen beweglich sind, ist eine fundamental wichtige Eigenschaft; in der Forschung nennt man sie Zellmotilität. Nur bewegungsfähige Zellen können mehrzellige Organismen mit verschiedenen Geweben ausbilden. Viele Immunzellen sind hochbeweglich, um etwa zu einem Infektionsherd oder in die Lymphknoten zu gelangen. Und Zellmotilität ist ein wichtiges Gebiet der Krebsforschung, in dem man versucht zu verstehen, wie Zellen aus einem Tumor metastasieren. Forschende des Helmholtz-Zentrums für Infektionsforschung und der Universität Bordeaux (Frankreich) konnten jetzt einen grundlegenden Mechanismus aufklären, der die Aktin-getriebene Fortbewegung einzelner Zellen reguliert.
Um sich in eine Richtung zu bewegen, stülpen Zellen definierte Bereiche ihrer Hülle aus. Das Wachstum der Lamellipodien genannten Ausstülpungen wird von Aktin getrieben: „Die Aktinfilamente bilden ein verzweigtes Netzwerk“, sagt HZI-Forscher Prof. Klemens Rottner, einer der Hauptautoren der im November erschienenen Studie. „Dieses Netzwerk ist total dynamisch.“ Aktinfilamente werden ständig in hoher Geschwindigkeit auf-, ab- und umgebaut. Sie wachsen dabei in eine Richtung schneller als in die andere. „Indem die schnell wachsenden Enden die Zellmembran auf kontrollierte Art und Weise voranschieben, bewegt sich die Spitze des Lamellipodiums auf dem Untergrund“, beschreibt Rottner.
An der Spitze des Lamellipodiums sitzen zahlreiche Proteine, die das Wachstum und die Verzweigung der Aktinfilamente kontrollieren. „Die kontinuierliche Verzweigung der Filamente ist fundamental für den Erhalt und den Aufbau des Aktinnetzwerkes“, sagt Klemens Rottner. Ein Aktivator der Verzweigung ist der WAVE-Proteinkomplex, der in der Zellmembran verankert ist. Die Forschenden um Grégory Giannone (Universität Bordeaux) und Klemens Rottner (HZI) beobachteten einzelne WAVE-Partikel mithilfe von fluoreszierenden Markierungen und superauflösender Mikroskopie. Sie erkannten, dass die mechanischen Kräfte, die die wachsenden Aktinfilamente auf den WAVE-Komplex ausüben, dessen Aktivität verringern. „Bisher hat man die Untersuchungen auf die Erforschung biochemischer Signale konzentriert, welche die Aktindynamik regulieren“, sagt Rottner. „Das Gebiet der biomechanischen Regulation ist dagegen noch ganz jung.“
Rottner interessiert sich seit seinen Studienzeiten für die zahlreichen Faktoren, welche den dynamischen Auf- und Abbau von Aktinfilamenten regulieren. Um ihre jeweilige Funktion zu untersuchen, hat seine Arbeitsgruppe am HZI mithilfe der CRISPR/Cas9-Methode eine ganze Sammlung von Zelllinien aufgebaut, denen jeweils einer dieser Faktoren fehlt. Die beiden Mitautor:innen Dr. Frieda Kage und Dr. Matthias Schaks waren wesentlich an der aufwendigen Entwicklung und Charakterisierung dieser Zelllinien-Sammlung beteiligt. Auch für einzelne Untereinheiten des WAVE-Komplexes hat die Gruppe solche Knockout-Zelllinien etabliert. Eine von ihnen statteten sie für die folgenden Experimente mit einer modifizierten Variante der fehlenden WAVE-Untereinheit aus. Ein Teil der im Labor genetisch konstruierten Proteinvariante reicht durch die Zellmembran hindurch bis an die Außenseite. Am äußeren Ende trägt sie zusätzlich ein grün fluoreszierendes Protein (GFP).
Rottners Kollege Giannone und dessen Mitarbeitende an der Universität Bordeaux benutzten dann winzige Polymerkügelchen, auf denen Antikörper gegen das GFP sitzen. Mithilfe einer optischen Pinzette, einer Pinzette aus LASER-Strahlen, können sie an diesen Kügelchen ziehen. Sie können präzise messen, wieviel Kraft es braucht, um den WAVE-Komplex - der über das GFP an dem Kügelchen hängt - im Zellinneren von der Spitze des Lamellipodiums zu lösen. Bezeichnenderweise lag die benötigte Kraft mit etwa zwei Piconewton in derselben Größenordnung wie die Kräfte, die einzelne Aktinfilamente bei ihrem Wachstum aus Einzelbausteinen ausüben.
Auf der Grundlage ihrer Beobachtungen haben die beiden Arbeitsgruppen ein Modell der Feedback-Kontrolle der Lamellipodien-basierten Zellmotilität entwickelt: Wachsen die Aktinfilamente in einem Lamellipodium langsam, reichert sich der WAVE-Komplex an der Spitze an. Diese Anreicherung beschleunigt das Aktinwachstum und die Netzwerk-Verzweigungen. Die mechanischen Kräfte der Aktinfilamente wirken deaktivierend auf die membranverankerten WAVE-Komplexe, sodass sich in der Folge das Wachstum der Filamente wieder verlangsamt und der WAVE-Komplex sich erneut an der Spitze des Lamellipodiums anreichern kann - und so fort (Abb. 1). „Unser Modell beschreibt zum ersten Mal einen Feedback-Regulationsmechanismus der Zellmotilität, der auf biomechanischen Signalen basiert“, sagt Klemens Rottner.
„Die detaillierte Analyse von Feedback-Mechanismen ist genau das, was das Aktin-Forschungsfeld braucht“, schreiben dazu die renommierten Aktin-Expert:innen Laura Machesky und Robert Insall in ihrem Kommentar zu Rottners und Giannones Studien, der in derselben Ausgabe von Nature Cell Biology veröffentlicht wurde. Und Klemens Rottner denkt bereits weiter: „Auch in der infektionsbiologischen Forschung könnten die von uns etablierten Methoden der Kräftemessung nützlich sein.“ So könnte er sich vorstellen, etwa die Interaktion von Wirtszellen mit Krankheitserregern - Bakterien oder perspektivisch sogar Viren - mit dieser Technologie zu untersuchen.
Originalpublikation:
Mehidi A, Kage F, Karatas Z, Cercy M, Schaks M, Polesskaya A, Sainlos M, Gautreau AM, Rossier O, Rottner K, Giannone G. Forces generated by lamellipodial actin filament elongation regulate the WAVE complex during cell migration. Nat Cell Biol. 2021 Nov 4. doi: 10.1038/s41556-021-00786-8. Epub ahead of print. PMID: 34737443.
News&Views Kommentar in derselben Ausgabe:
Machesky LM, Insall RH. WAVE complex regulation by force. Nat Cell Biol. 2021 Nov 4. doi: 10.1038/s41556-021-00790-y. Epub ahead of print. PMID: 34737441.
Autorin: Dr. Ulrike Schneeweiß