RNA-Biologie gram-positiver Bakterien

Unsere Forschung
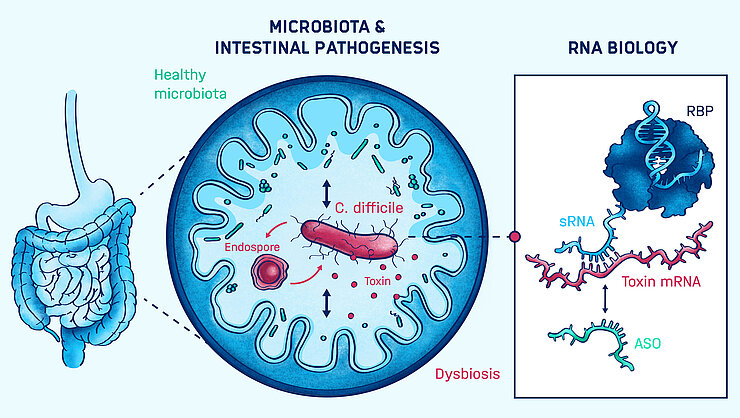
Darminfektionen stehen häufig in Zusammenhang mit einer zugrundeliegenden mikrobiellen Dysbiose, also einem Ungleichgewicht der Darmflora. Ein gutes Beispiel ist das Bakterium Clostridioides difficile – eine der Hauptursachen für Antibiotika-assoziierte Durchfallerkrankungen: Bei gesunden Menschen verläuft die Infektion mit C. difficile symptomlos. Nach einer Antibiotikabehandlung verursacht das Darmpathogen jedoch ein breites Spektrum an Krankheiten. Daher ist ein grundlegendes Verständnis der Virulenzregulation im Kontext von Pathogen-Mikrobiota-Interaktionen von entscheidender Bedeutung für die Entwicklung neuer RNA-basierter Therapeutika.
Die Gruppe um Franziska Faber verfolgt dieses Ziel durch die molekulare Charakterisierung der Virulenzregulation, wobei ihr Schwerpunkt auf der posttranskriptionellen Regulation durch nicht-kodierende RNAs und deren RNA-bindenden Proteinen liegt. Außerdem charakterisiert sie mikrobielle und Wirtssignale, die die Expression von Virulenzgenen regulieren. Weiter erforscht die Faber-Gruppe, wie Gene und Signalwege, die für die Virulenz wichtig sind, mithilfe von Antisense-Oligomeren modifiziert werden können.
Bei seiner Arbeit kombiniert das Team Technologien aus den Bereichen der RNA-Biologie, Biochemie, Metabolomik, Genetik und Mikrobiologie. Das übergeordnete Ziel der Faber-Gruppe ist die Identifizierung und Charakterisierung RNA-basierter Mechanismen der Virulenzregulation, die als therapeutische Angriffspunkte genutzt werden können.
Unsere Forschung
Darminfektionen stehen häufig in Zusammenhang mit einer zugrundeliegenden mikrobiellen Dysbiose, also einem Ungleichgewicht der Darmflora. Ein gutes Beispiel ist das Bakterium Clostridioides difficile – eine der Hauptursachen für Antibiotika-assoziierte Durchfallerkrankungen: Bei gesunden Menschen verläuft die Infektion mit C. difficile symptomlos. Nach einer Antibiotikabehandlung verursacht das Darmpathogen jedoch ein breites Spektrum an Krankheiten. Daher ist ein grundlegendes Verständnis der Virulenzregulation im Kontext von Pathogen-Mikrobiota-Interaktionen von entscheidender Bedeutung für die Entwicklung neuer RNA-basierter Therapeutika.
Die Gruppe um Franziska Faber verfolgt dieses Ziel durch die molekulare Charakterisierung der Virulenzregulation, wobei ihr Schwerpunkt auf der posttranskriptionellen Regulation durch nicht-kodierende RNAs und deren RNA-bindenden Proteinen liegt. Außerdem charakterisiert sie mikrobielle und Wirtssignale, die die Expression von Virulenzgenen regulieren. Weiter erforscht die Faber-Gruppe, wie Gene und Signalwege, die für die Virulenz wichtig sind, mithilfe von Antisense-Oligomeren modifiziert werden können.
Bei seiner Arbeit kombiniert das Team Technologien aus den Bereichen der RNA-Biologie, Biochemie, Metabolomik, Genetik und Mikrobiologie. Das übergeordnete Ziel der Faber-Gruppe ist die Identifizierung und Charakterisierung RNA-basierter Mechanismen der Virulenzregulation, die als therapeutische Angriffspunkte genutzt werden können.
RNAs haben sich als wichtige Regulatoren der Virulenz von C. difficile herausgestellt. Wir versuchen, die molekularen Mechanismen dieser Regulatoren zu charakterisieren und herauszufinden, wie sie für die Behandlung von C. difficile-Infektionen genutzt werden können.
Prof. Dr. Franziska Faber

Franziska Faber studierte Biologie an der Martin-Luther-Universität (Halle/Saale). Im Rahmen ihrer Doktorarbeit am Robert-Koch-Institut (Wernigerode) beschäftigte sie sich mit bakteriellen Darminfektionen. Im Jahr 2011 begann sie ihre Postdoc-Tätigkeit im Labor von Andreas Bäumler an der Universität von Kalifornien (Davis, USA). Dort untersuchte sie die Mechanismen, durch die eine Antibiotikabehandlung die „Kolonisationsresistenz“ gegen den Darmerreger Salmonella enterica verringert. Insbesondere erforschte sie, wie entzündungsbedingte Veränderungen der Nährstoffversorgung des Darms zur Besiedlung mit S. enterica beitragen. Im Jahr 2018 wechselte sie als Young Investigator an das Zentrum für Infektionsforschung (ZINF) in Würzburg, um die bisher unerforschte RNA-Biologie des Darmpathogens Clostridioides difficile zu untersuchen. Seit 2021 war sie Juniorprofessorin am Institut für Molekulare Infektionsbiologie (IMIB) und leitet seitdem die ROSE-Gruppe der Julius-Maximilians-Universität (JMU) Würzburg, die mit dem HIRI assoziiert ist. Im Jahr 2023 folgte sie dem Ruf auf eine W2-Professur am Institut für Hygiene und Mikrobiologie der JMU.
Ausgewählte Publikationen
Lenče T*, Sulzer J*, Andress K, Gribling-Burrer A-S, Lamm-Schmidt V, Barquist L, Smyth RP, Faber F (2024)
The conserved noncoding RNA ModT coordinates growth and virulence in Clostridioides difficile.
PLoS Biology 22(12):e3002948
Fuchs M, Lamm-Schmidt V, Lenče T, Sulzer J, Bublitz A, Wackenreuter J, Gerovac M, Strowig T, Faber F (2023)
A network of small RNAs regulates sporulation initiation in C. difficile
EMBO Journal 42(12):e112858
Fuchs M*, Lamm-Schmidt V*, Sulzer J, Ponath F, Jenniches L, Kirk JA, Fagan RP, Barquist L, Vogel J, Faber F (2021)
An RNA-centric global view of the clinically important bacterium Clostridioides difficile reveals broad activity of Hfq in a Gram-positive species
PNAS 118(25):e2103579118
Lamm-Schmidt V, Fuchs M, Sulzer J, Gerovac M, Hör J, Dersch P, Vogel J, Faber F (2021)
Grad-seq identifies KhpB as a global RNA-binding protein in Clostridioides difficile that regulates toxin production
microLife 2:uqab004
Faber F, Tran L, Byndloss MX, Lopez CA, Velazquez EM, Kerrinnes T, Nuccio SP, Wangdi T, Fiehn O, Tsolis RM, Bäumler AJ (2016)
Host-mediated sugar oxidation promotes post-antibiotic pathogen expansion
Nature 534(7609):697-699