
Unsere Forschung
Die von Lina Herhaus geführte Arbeitsgruppe Zelluläre Immunsignale (IMSI) am Helmholtz-Zentrum für Infektionsforschung (HZI) konzentriert sich darauf zu verstehen, wie das Immunsystem Bedrohungen wie Infektionen und daraus resultierende Entzündungen erkennt und darauf reagiert. Durch die Erforschung der molekularen Mechanismen, die Immun-Signalwege regulieren, will die Gruppe herausfinden, wie Zellen die Protein-Homöostase aufrechterhalten und sich vor pathogenen Herausforderungen schützen. Diese Arbeit hat weitreichende Auswirkungen auf die öffentliche Gesundheit, da sie sich mit grundlegenden Fragen darüber befasst, wie der Körper Infektionen bekämpft und Fehlfunktionen des Immunsystems vermeidet.
Im Mittelpunkt ihrer Forschung steht die Untersuchung posttranslationaler Modifikationen und der Frage, wie diese molekularen „Schalter“ die Immunsignalgebung und die zelluläre Qualitätskontrolle beeinflussen. Eines der Hauptziele der Gruppe ist es zu verstehen, wie Immunzellen fehlgefaltete oder beschädigte Proteine erkennen und abbauen, um die Gesundheit der Zellen zu gewährleisten - ein Prozess, der für die Bekämpfung von Infektionen und die Verhinderung von Krankheiten entscheidend ist. Die Gruppe untersucht auch, wie Krankheitserreger diese Prozesse ausnutzen oder umgehen, um Infektionen zu verursachen, und wie die Wirtszellen diesen Strategien entgegenwirken.
Ein wichtiger Schwerpunkt ist die Rolle der Autophagie und des Vesikeltransports bei der Immunregulation. Das Team ist besonders daran interessiert, wie diese Wege zur Aktivierung von Immunzellen und zur Beseitigung von Krankheitserregern beitragen. Mit Hilfe modernster Technologien, einschließlich Proteomik, Bildgebung und funktioneller Genomik, untersucht die Gruppe das Zusammenspiel zwischen Immunsignalen und zellulärem Stoffwechsel. Ihre Forschung zielt darauf ab, molekulare Schlüsselakteure wie das Protein IRGQ zu identifizieren, die als Regulatoren der Qualitätskontrolle des Immunsystems und als potenzielle therapeutische Ziele fungieren könnten.
Die Arbeit der Gruppe „Zelluläre Immunsignale“ ist für die Gesellschaft von großer Bedeutung, da sie zur Entwicklung neuer Behandlungen für Infektions- und Entzündungskrankheiten beiträgt. Durch die Aufdeckung der Mechanismen, die den Immunreaktionen zugrunde liegen, hat ihre Forschung das Potenzial, innovative Therapien voranzutreiben, die das Immunsystem für die Bekämpfung von Krankheiten nutzbar machen. Dieses Wissen könnte zur Entwicklung von Konzepten der Präzisionsmedizin führen, von denen Patient:innen mit Erkrankungen von chronischen Infektionen bis hin zu Tumoren profitieren könnten. Auf diese Weise trägt die Gruppe dazu bei, sowohl das wissenschaftliche Grundlagenverständnis als auch die translationale medizinische Forschung zum Wohle der öffentlichen Gesundheit voranzutreiben.
Unsere Forschung
Die von Lina Herhaus geführte Arbeitsgruppe Zelluläre Immunsignale (IMSI) am Helmholtz-Zentrum für Infektionsforschung (HZI) konzentriert sich darauf zu verstehen, wie das Immunsystem Bedrohungen wie Infektionen und daraus resultierende Entzündungen erkennt und darauf reagiert. Durch die Erforschung der molekularen Mechanismen, die Immun-Signalwege regulieren, will die Gruppe herausfinden, wie Zellen die Protein-Homöostase aufrechterhalten und sich vor pathogenen Herausforderungen schützen. Diese Arbeit hat weitreichende Auswirkungen auf die öffentliche Gesundheit, da sie sich mit grundlegenden Fragen darüber befasst, wie der Körper Infektionen bekämpft und Fehlfunktionen des Immunsystems vermeidet.
Im Mittelpunkt ihrer Forschung steht die Untersuchung posttranslationaler Modifikationen und der Frage, wie diese molekularen „Schalter“ die Immunsignalgebung und die zelluläre Qualitätskontrolle beeinflussen. Eines der Hauptziele der Gruppe ist es zu verstehen, wie Immunzellen fehlgefaltete oder beschädigte Proteine erkennen und abbauen, um die Gesundheit der Zellen zu gewährleisten - ein Prozess, der für die Bekämpfung von Infektionen und die Verhinderung von Krankheiten entscheidend ist. Die Gruppe untersucht auch, wie Krankheitserreger diese Prozesse ausnutzen oder umgehen, um Infektionen zu verursachen, und wie die Wirtszellen diesen Strategien entgegenwirken.
Ein wichtiger Schwerpunkt ist die Rolle der Autophagie und des Vesikeltransports bei der Immunregulation. Das Team ist besonders daran interessiert, wie diese Wege zur Aktivierung von Immunzellen und zur Beseitigung von Krankheitserregern beitragen. Mit Hilfe modernster Technologien, einschließlich Proteomik, Bildgebung und funktioneller Genomik, untersucht die Gruppe das Zusammenspiel zwischen Immunsignalen und zellulärem Stoffwechsel. Ihre Forschung zielt darauf ab, molekulare Schlüsselakteure wie das Protein IRGQ zu identifizieren, die als Regulatoren der Qualitätskontrolle des Immunsystems und als potenzielle therapeutische Ziele fungieren könnten.
Die Arbeit der Gruppe „Zelluläre Immunsignale“ ist für die Gesellschaft von großer Bedeutung, da sie zur Entwicklung neuer Behandlungen für Infektions- und Entzündungskrankheiten beiträgt. Durch die Aufdeckung der Mechanismen, die den Immunreaktionen zugrunde liegen, hat ihre Forschung das Potenzial, innovative Therapien voranzutreiben, die das Immunsystem für die Bekämpfung von Krankheiten nutzbar machen. Dieses Wissen könnte zur Entwicklung von Konzepten der Präzisionsmedizin führen, von denen Patient:innen mit Erkrankungen von chronischen Infektionen bis hin zu Tumoren profitieren könnten. Auf diese Weise trägt die Gruppe dazu bei, sowohl das wissenschaftliche Grundlagenverständnis als auch die translationale medizinische Forschung zum Wohle der öffentlichen Gesundheit voranzutreiben.
Dr. Lina Herhaus
Das Verständnis der zellulären Kommunikation ist der Schlüssel zur Bekämpfung von Infektionen. Unsere Forschung fördert molekulare Erkenntnisse zutage, die unser Wissen über Gesundheit und Krankheit verändern können.

Lina Herhaus ist eine versierte Wissenschaftlerin mit den Schwerpunkten Biochemie, Zellsignalisierung und Immunforschung. Seit Oktober 2024 leitet sie die durch das MICROSTAR-Programm geförderte Nachwuchsgruppe „Zelluläre Immunsignale“ am Helmholtz-Zentrum für Infektionsforschung (HZI) und ist als W1-Professorin an der Medizinischen Hochschule Hannover (MHH) tätig. Zuvor leitete sie die „Immune Signaling Group“ an der Goethe-Universität Frankfurt (2020 - 2024) und förderte das Verständnis von Immunwegen und molekularen Mechanismen.
Linas Forschungslaufbahn spiegelt ihre Leidenschaft für die Erforschung komplexer zellulärer Prozesse wider. Von 2019 bis 2020 arbeitete sie als wissenschaftliche Mitarbeiterin am Frankfurter Krebsinstitut, wo sie sich auf zelluläre und biochemische Analysen spezialisierte. Davor erhielt sie ein EMBO Long-Term Fellowship und arbeitete als Postdoktorandin im Labor von Prof. Ivan Dikic am Institut für Biochemie II, Frankfurt (2015-2019), wo sie ihre Expertise in den Bereichen Proteinsignalübertragung und Autophagie vertiefte.
Lina promovierte 2014 am MRC in Dundee bei Dr. Gopal Sapkota in Biochemie und Zellsignalisierung und erforschte dabei molekulare Signalwege. Sie hat einen Doppelabschluss in Molekularbiologie und Angewandter Biologie (mit Auszeichnung, 2010) von der Hochschule Bonn-Rhein-Sieg und der University of Dundee. Zu Beginn ihrer Karriere verbrachte sie einen Forschungsaufenthalt bei ECOSUR in Mexiko (2006-2007).
Ihre Beiträge zur Wissenschaft sind weithin anerkannt worden. Im Jahr 2024 erhielt sie den Signal Transduction Society (STS) Science Award und wurde in den AIM (Autophagy, Inflammation & Metabolism) Council of International Rising Stars aufgenommen. Zuvor hatte sie bereits den Tim-Hunt-Preis für Zellbiologie (2013) für ihre innovativen Fortschritte in der Grundlagenforschung erhalten.
Team





Publikationen
Ausgewählte Publikationen
- Herhaus, L., Gestal-Mato, U., Eapen, V. V., Macinkovic, I., Bailey, H. J., Prieto Garcia, C., Misra, M., Jacomin, A. C., Ammanath, A. V., Covarrubias-Pinto, A., Michaelis, J., Bagaric, I., Zöllner, J., Bhaskara, R.M., Bündgen, G., Husnjak, K., Vollrath, J., Gikandi, A., Ribicic, S., Langer, J., Bopp, T., Weigert, A., Mancias, J., Harper, J.W., and Dikic, I.(2024). IRGQ-mediated autophagy in MHC-I quality control promotes tumor immune evasion. Cell. https://doi.org/10.1016/J.CELL.2024.09.048.
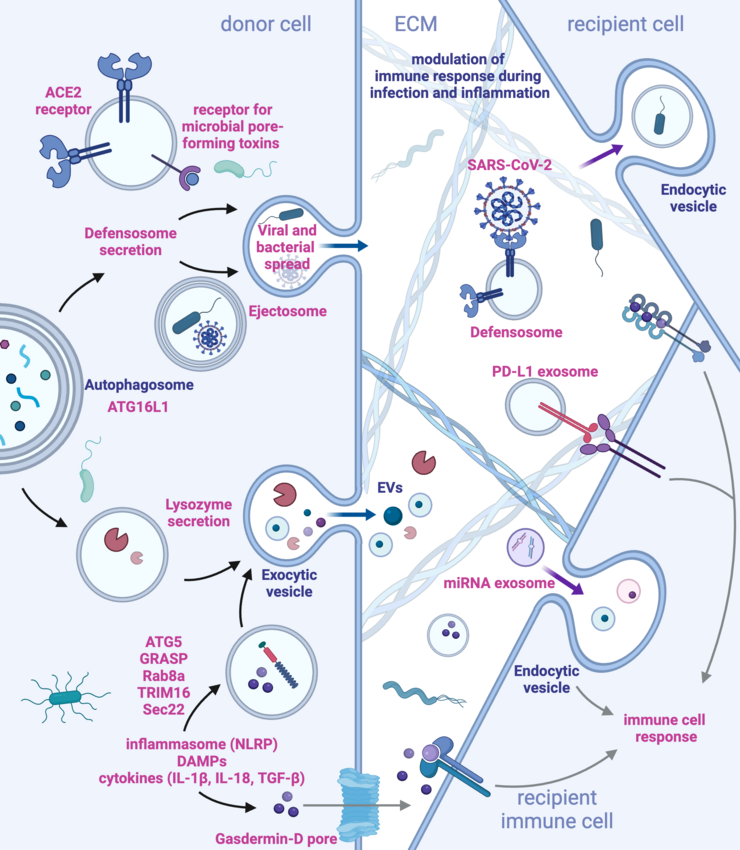
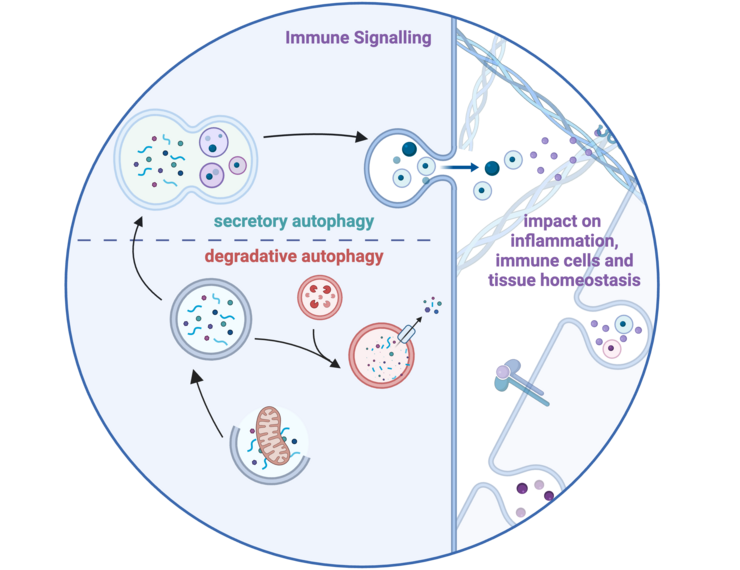
- Weigert, A., and Herhaus, L. (2023). Immune modulation through secretory autophagy. J Cell Biochem. 10.1002/JCB.30427. https://onlinelibrary.wiley.com/doi/full/10.1002/jcb.30427
- Gestal-Mato, U., and Herhaus, L. (2023). Autophagy-dependent regulation of MHC-I molecule presentation. J Cell Biochem. 10.1002/JCB.30416. https://onlinelibrary.wiley.com/doi/10.1002/jcb.30416
- Herhaus, L. (2021). TBK1 (TANK-binding kinase 1)-mediated regulation of autophagy in health and disease. Matrix Biol 100–101, 84–98. 10.1016/j.matbio.2021.01.004. https://www.sciencedirect.com/science/article/pii/S0945053X21000056
- Herhaus, L., Bhaskara, R.M., (…), Dikic, I. (2020). TBK1-mediated phosphorylation of LC3C and GABARAP-L2 controls autophagosome shedding by ATG4 protease. EMBO Rep 21, e48317. 10.15252/embr.201948317. https://www.embopress.org/doi/full/10.15252/embr.201948317
Projekte
Autophagie-Mechanismen bei der interzellulären Erkennung der Gewebehomöostase durch das Immunsystem
Störungen der Gewebehomöostase lösen Immunreaktionen aus, um das Gleichgewicht wiederherzustellen. Die nicht-kanonische Autophagie, die für die zelluläre Homöostase von entscheidender Bedeutung ist, und ihre Erkennung durch das Immunsystem sind bisher kaum verstanden. In diesem Projekt wird untersucht, wie die Autophagie Immunreaktionen beeinflusst, wobei der Schwerpunkt auf der Regulierung von MHC-I-ähnlichen Molekülen und der Rolle der sekretorischen Autophagie bei der Sekretion extrazellulärer Vesikel (EV) liegt. Mit Hilfe von genetischen Screens, High-Parameter-Imaging, automatisierter Mikroskopie und Omics-Ansätzen in Maus- und Humanmodellen wollen wir herausfinden, wie Autophagie-gesteuerte Prozesse die immunabhängige Gewebehomöostase unter normalen und gestörten Bedingungen beeinflussen.
Förderung: DFG im Rahmen des SFB1177