Zentrale Einheit für Mikroskopie


Unsere Expertise
Die Zentrale Einheit für Mikroskopie, kurz ZEIM, stellt die Geräteausstattung und die Expertise in der Präparation biologischer Proben zur Verfügung. Für diese Aufgaben verfügt ZEIM über mehrere Fluoreszenzmikroskope (FM), Konfokale Mikroskope (CLSM), zwei Transmissions-Elektronenmikroskope (TEM) und ein Feldemissions-Rasterelektronenmikroskop (FESEM) sowie die notwendigen peripheren Präparationsgeräte.
Da mikroskopische Experimente meist verschiedenartig verlaufen und besondere Anforderungen erfüllen müssen, kooperiert das Team von ZEIM eng mit den Wissenschaftler:innen, um für das vorgesehene Experiment zugeschnittene Präparationsmethoden und Abbildungstechniken zu etablieren. ZEIM kann dabei auf ein großes Portfolio verschiedener Methoden der Licht- und Elektronenmikroskopie zugreifen.
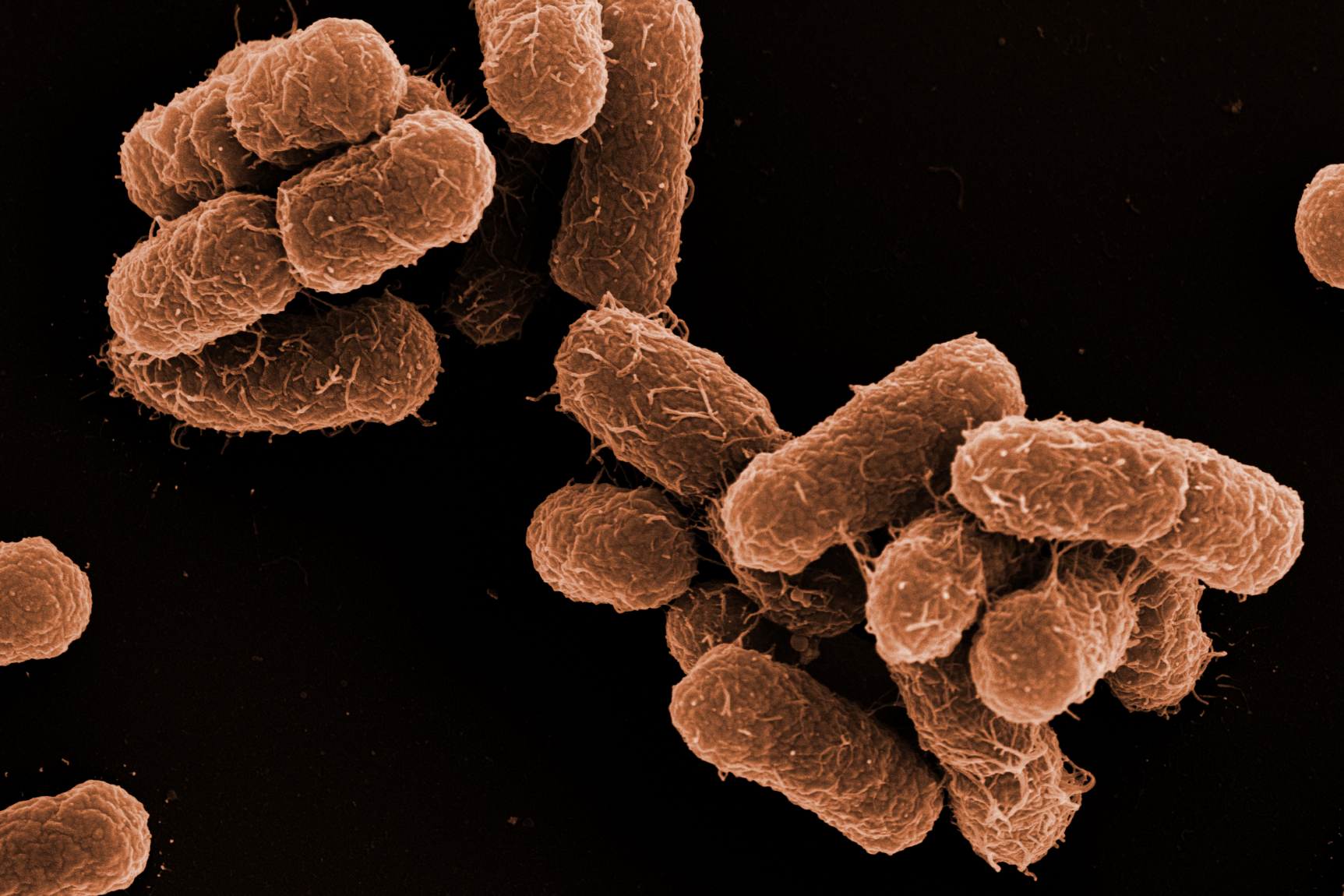
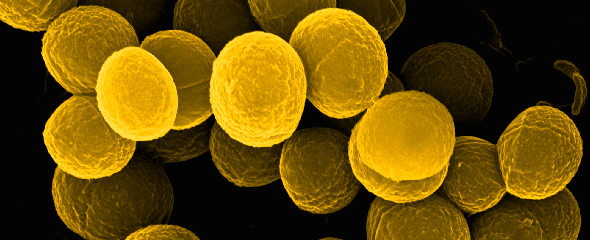
Die große Expertise in der elektronenmikroskopischen Präparation biologischer Proben ist eine besondere Stärke unseres EM-Service. Eine weitere Stärke liegt in der morphologischen Beschreibung von neu isolierten Bakterien und Bakteriophagen. Darüber hinaus bietet ZEIM die Möglichkeit, Infektionen mit pathogenen Bakterien an Zelllinien durchzuführen. Dies beinhaltet die anschließende Probenpräparation, Betrachtung und Erstellung von Bildern sowie die Auswertung für Publikationen.
Im Bereich der FM/CLSM werden die Wissenschaftler:innen bei den Aufnahmen am Fluoreszenzmikroskop oder Konfokalen Mikroskop unterstützt oder erhalten eine entsprechende Einweisung zum eigenständigen Aufnehmen von Bildern. Darüber hinaus werden neben klassischen Fluoreszenzmarkierungen auch Doppelmarkierungen zur Unterscheidung extra- und intrazellulärer Bakterien angeboten.
Transmissionselektronenmikroskopie (TEM)
Neben der schnell auszuführenden Negativ-Kontrastierung zur Darstellung von Bakterien, Bakteriophagen und Vesikeln kommen vielfältige Einbettungstechniken zum Einsatz, zum Beispiel Tieftemperatureinbettungen und Hochdruckgefrieren mit anschließender Gefriersubstitution, um Proben nachfolgend im Ultradünnschnitt mittels TEM zu analysieren. Expertise in der Immunzytochemie ist ebenfalls vorhanden, um Pathogenitätsfaktoren, beispielsweise mit Hilfe von Antikörpern und Goldnanopartikeln in eukaryontischen Zellen oder Bakterien am Ultradünnschnitt nachzuweisen.
AUSSTATTUNG:
- Transmissionselektronenmikroskop Zeiss Libra120 Plus
- Transmissionselektronenmikroskop Zeiss TEM910
- Ultramikrotom Leica UC7 mit Cryokammer FC7
- Ultramikrotom Reichert Ultracut S,
- Hochdruckgefrierer Leica EM-Pact 1
- Bedampfungsanlage Bal-Tec MED 020
- Gefriersubstitution Leica EM AFS
Feldemissions-Rasterelektronenmikroskopie (FESEM)
Für die hochauflösende Feldemissions-Rasterelektronenmikroskopie (FESEM) verwenden wir spezielle ZEIM-Standardprotokolle, die sich für eine erste erfolgreiche Präparation eignen. So können Infektionsprozesse und Oberflächenstrukturen präzise dargestellt werden. Für besondere Fragestellungen werden neue Präparationsansätze getestet und gegebenenfalls etabliert. Auch die FESEM kann mit der Immunzytochemie gekoppelt werden.
AUSSTATTUNG:
- Feldemissions-Rasterelektronenmikroskop Zeiss Merlin mit Atlas, STEM Detektor, EsB-Detektor für Materialkontrast, Shuttle&Find für CLEM (korrelative Licht- und Elektronenmikroskopie) und Oxford EDX Aztec mit X-Max Detektor
- Kritische Punkttrocknungsapparatur Leica EM CPD300
- Sputter Coater Bal-Tec SCD 500
Fluoreszenz (FM)- und Konfokale Laser-Scanningmikroskopie (CLSM)
Die FM/CLSM bietet die Möglichkeit selektiv angefärbte Kompartimente und Elemente in Zellen sichtbar zu machen. Die Anfärbung kann dabei über Fluoreszenzfarbstoffe, fluoreszierende Proteine oder Fluoreszenz-gelabelte Antikörper erfolgen. Der große Vorteil gegenüber der EM: Neben fixierten Proben können auch Aufnahmen von lebenden Präparaten erfolgen. Bei komplexen, dreidimensionalen Strukturen ist dabei die konfokale Laser-Scanning Mikroskopie das Mittel der Wahl, da sie die Möglichkeit optischer Schnitte erlaubt, die im Nachgang wieder zu einem 3D Volumen zusammengesetzt werden können. Eine entsprechende, kommerzielle Software zur Bildanalyse (Imaris 9.3, Oxford Instruments) ist ebenfalls bei ZEIM verfügbar.
AUSSTATTUNG:
- Zeiss Axio Imager A2
- Zeiss Axio Imager A1
- Zeiss Axio Observer Z1 mit Apotome
- Zeiss Imager Z2
- Leica SP5 aufrechtes Konfokales Laser-Scanning Mikroskop
- Leica SP8 inverses Konfokales Laser-Scanning Mikroskop
- Bildanalysesoftware: Imaris version 9.3.
Unsere Expertise
Die Zentrale Einheit für Mikroskopie, kurz ZEIM, stellt die Geräteausstattung und die Expertise in der Präparation biologischer Proben zur Verfügung. Für diese Aufgaben verfügt ZEIM über mehrere Fluoreszenzmikroskope (FM), Konfokale Mikroskope (CLSM), zwei Transmissions-Elektronenmikroskope (TEM) und ein Feldemissions-Rasterelektronenmikroskop (FESEM) sowie die notwendigen peripheren Präparationsgeräte.
Da mikroskopische Experimente meist verschiedenartig verlaufen und besondere Anforderungen erfüllen müssen, kooperiert das Team von ZEIM eng mit den Wissenschaftler:innen, um für das vorgesehene Experiment zugeschnittene Präparationsmethoden und Abbildungstechniken zu etablieren. ZEIM kann dabei auf ein großes Portfolio verschiedener Methoden der Licht- und Elektronenmikroskopie zugreifen.
Die große Expertise in der elektronenmikroskopischen Präparation biologischer Proben ist eine besondere Stärke unseres EM-Service. Eine weitere Stärke liegt in der morphologischen Beschreibung von neu isolierten Bakterien und Bakteriophagen. Darüber hinaus bietet ZEIM die Möglichkeit, Infektionen mit pathogenen Bakterien an Zelllinien durchzuführen. Dies beinhaltet die anschließende Probenpräparation, Betrachtung und Erstellung von Bildern sowie die Auswertung für Publikationen.
Im Bereich der FM/CLSM werden die Wissenschaftler:innen bei den Aufnahmen am Fluoreszenzmikroskop oder Konfokalen Mikroskop unterstützt oder erhalten eine entsprechende Einweisung zum eigenständigen Aufnehmen von Bildern. Darüber hinaus werden neben klassischen Fluoreszenzmarkierungen auch Doppelmarkierungen zur Unterscheidung extra- und intrazellulärer Bakterien angeboten.
Transmissionselektronenmikroskopie (TEM)
Neben der schnell auszuführenden Negativ-Kontrastierung zur Darstellung von Bakterien, Bakteriophagen und Vesikeln kommen vielfältige Einbettungstechniken zum Einsatz, zum Beispiel Tieftemperatureinbettungen und Hochdruckgefrieren mit anschließender Gefriersubstitution, um Proben nachfolgend im Ultradünnschnitt mittels TEM zu analysieren. Expertise in der Immunzytochemie ist ebenfalls vorhanden, um Pathogenitätsfaktoren, beispielsweise mit Hilfe von Antikörpern und Goldnanopartikeln in eukaryontischen Zellen oder Bakterien am Ultradünnschnitt nachzuweisen.
AUSSTATTUNG:
- Transmissionselektronenmikroskop Zeiss Libra120 Plus
- Transmissionselektronenmikroskop Zeiss TEM910
- Ultramikrotom Leica UC7 mit Cryokammer FC7
- Ultramikrotom Reichert Ultracut S,
- Hochdruckgefrierer Leica EM-Pact 1
- Bedampfungsanlage Bal-Tec MED 020
- Gefriersubstitution Leica EM AFS
Feldemissions-Rasterelektronenmikroskopie (FESEM)
Für die hochauflösende Feldemissions-Rasterelektronenmikroskopie (FESEM) verwenden wir spezielle ZEIM-Standardprotokolle, die sich für eine erste erfolgreiche Präparation eignen. So können Infektionsprozesse und Oberflächenstrukturen präzise dargestellt werden. Für besondere Fragestellungen werden neue Präparationsansätze getestet und gegebenenfalls etabliert. Auch die FESEM kann mit der Immunzytochemie gekoppelt werden.
AUSSTATTUNG:
- Feldemissions-Rasterelektronenmikroskop Zeiss Merlin mit Atlas, STEM Detektor, EsB-Detektor für Materialkontrast, Shuttle&Find für CLEM (korrelative Licht- und Elektronenmikroskopie) und Oxford EDX Aztec mit X-Max Detektor
- Kritische Punkttrocknungsapparatur Leica EM CPD300
- Sputter Coater Bal-Tec SCD 500
Fluoreszenz (FM)- und Konfokale Laser-Scanningmikroskopie (CLSM)
Die FM/CLSM bietet die Möglichkeit selektiv angefärbte Kompartimente und Elemente in Zellen sichtbar zu machen. Die Anfärbung kann dabei über Fluoreszenzfarbstoffe, fluoreszierende Proteine oder Fluoreszenz-gelabelte Antikörper erfolgen. Der große Vorteil gegenüber der EM: Neben fixierten Proben können auch Aufnahmen von lebenden Präparaten erfolgen. Bei komplexen, dreidimensionalen Strukturen ist dabei die konfokale Laser-Scanning Mikroskopie das Mittel der Wahl, da sie die Möglichkeit optischer Schnitte erlaubt, die im Nachgang wieder zu einem 3D Volumen zusammengesetzt werden können. Eine entsprechende, kommerzielle Software zur Bildanalyse (Imaris 9.3, Oxford Instruments) ist ebenfalls bei ZEIM verfügbar.
AUSSTATTUNG:
- Zeiss Axio Imager A2
- Zeiss Axio Imager A1
- Zeiss Axio Observer Z1 mit Apotome
- Zeiss Imager Z2
- Leica SP5 aufrechtes Konfokales Laser-Scanning Mikroskop
- Leica SP8 inverses Konfokales Laser-Scanning Mikroskop
- Bildanalysesoftware: Imaris version 9.3.
Unsere Forschung
Zusätzlich zu den eigentlichen Service-Arbeiten bringen wir uns aktiv in wissenschaftliche Kooperationen ein. Wir nutzen speziell bildgebende Verfahren und entsprechenden Analysen, um Fragestellungen entsprechend zu adressieren. Dabei spielt die starke mikrobiologische und zellbiologische Expertise des ZEIM Teams eine besondere Rolle. Ein Schwerpunkt der Forschung ist die Visualisierung der Wirkstoffkinetik von antimikrobiellen Substanzen innerhalb bakterieller Gemeinschaften – sogenannten Biofilmen – mit unterschiedlichen Mikroskopie Verfahren.Ein besonderer Fokus liegt dabei auf den beiden klinisch relevanten Modell-Organismen Pseudomonas aeruginosa und Staphylococcus aureus. Mit herausragenden Kooperationspartnern werden aber auch weiterhin Projekte rund um die Gruppe der Streptokokken bearbeitet.




Ausgewählte Publikationen
Osbelt L, Almási ÉDH, Wende M, Kienesberger S, Voltz A, Lesker TR, Muthukumarasamy U, Knischewski N, Nordmann E, Bielecka AA, Giralt-Zúñiga M, Kaganovitch E, Kühne C, Baier C, Pietsch M, Müsken M, Greweling-Pils MC, Breinbauer R, Flieger A, Schlüter D, Müller R, Erhardt M, Zechner EL, Strowig T. Klebsiella oxytoca inhibits Salmonella infection through multiple microbiotacontext-dependent mechanisms. Nat Microbiol. 2024 Jul;9(7):1792-1811. doi: 10.1038/s41564-024-01710-0
Bublitz A, Brauer M, Wagner S, Hofer W, Müsken M, Deschner F, Lesker TR, Neumann-Schaal M, Paul LS, Nübel U, Bartel J, Kany AM, Zühlke D, Bernecker S, Jansen R, Sievers S, Riedel K, Herrmann J, Müller R, Fuchs TM, Strowig T. The natural product chlorotonil A preserves colonization resistance and prevents relapsing Clostridioides difficile infection. Cell Host Microbe. 2023 May 10;31(5):734-750.e8. doi: 10.1016/j.chom.2023.04.003.
Thöming JG, Tomasch J, Preusse M, Koska M, Grahl N, Pohl S, Willger SD, Kaever V, Müsken M, Häussler S. Parallel evolutionary paths to produce more than one Pseudomonas aeruginosa biofilm phenotype. NPJ Biofilms Microbiomes. 2020 Jan 10;6:2. doi: 10.1038/s41522-019-0113-6.
Müsken M, Pawar V, Schwebs T, Bähre H, Felgner S, Weiss S, Häussler S. Breaking the vicious cycle of antibiotic killing and regrowth of biofilm-residing Pseudomonas aeruginosa. Antimicrob Agents Chemother. 2018 Nov 26;62(12):e01635-18. doi: 10.1128/AAC.01635-18
Müsken M, Di Fiore S, Römling U, Häussler S. A 96-well-plate-based optical method for the quantitative and qualitative evaluation of Pseudomonas aeruginosa biofilm formation and its application to susceptibility testing. Nat Protoc. 2010 Aug;5(8):1460-9. doi:10.1038/nprot.2010.110