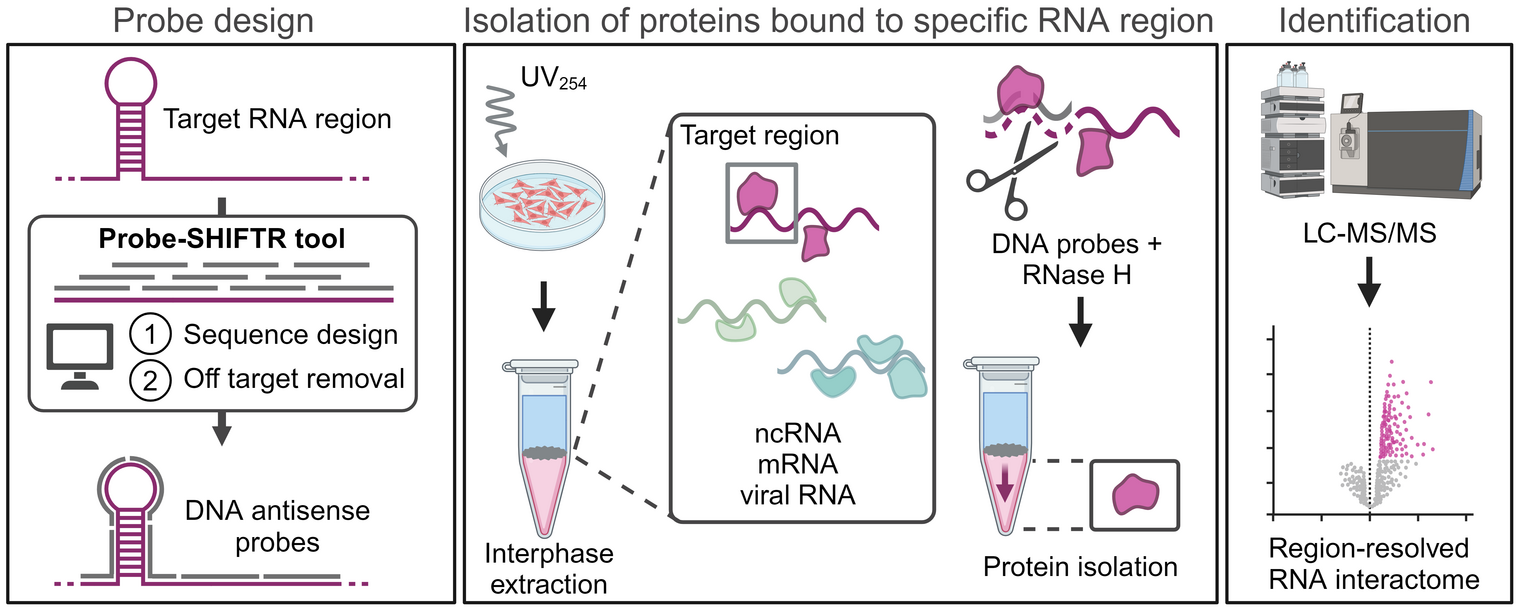
„Bisher war es nicht möglich, das Zusammenspiel von Proteinen und einzelnen RNA-Abschnitten in intakten Zellen zu untersuchen, ohne die Ziel-RNA oder -zelle genetisch zu modifizieren. Unsere SHIFTR-Methode eröffnet uns endlich diese Möglichkeit und ist zudem einfach durchzuführen. SHIFTR erlaubt nicht nur die Betrachtung einzelner Regionen, sondern benötigt im Vergleich zu herkömmlichen Verfahren wesentlich weniger Ausgangsmaterial, ist in hohem Maße skalierbar und kostengünstig“, erklärt Mathias Munschauer, der eine Forschungsgruppe am Helmholtz-Institut Würzburg leitet, einem Standort des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) in Kooperation mit der Julius-Maximilians-Universität (JMU) Würzburg.
„Mit diesem neuen Werkzeug können wir die Interaktionen für praktisch jede zelluläre RNA und jedes regulatorische Element innerhalb dieser RNAs bestimmen“, sagt Jens Aydin, Doktorand in der Arbeitsgruppe von Mathias Munschauer und Erstautor der Studie in Nucleic Acids Research. „Das kann die Art und Weise, wie wir die RNA einer Zelle betrachten, grundlegend verändern – ein wichtiger Meilenstein“, ergänzt Munschauer.
SARS-CoV-2 im Visier
Mithilfe der neuen Methode konnte das Forschungsteam den Vermehrungsprozess von SARS-CoV-2 weiter beleuchten: Die Wissenschaftler:innen untersuchten verschiedene Sequenzelemente in SARS-CoV-2-RNAs, die während einer Infektion produziert werden. Zum ersten Mal gelang es ihnen, die Interaktionen an den 5'- und 3'-Endregionen der viralen RNA zu erfassen. Diese Bereiche enthalten bekanntermaßen regulatorische Elemente, die die Proteinproduktion, die RNA-Stabilität und die Replikation des viralen Genoms kontrollieren. Zusätzlich zu den bereits bekannten Akteuren entdeckten sie bisher noch nicht beobachtete Interaktionen mit Proteinen, die an der Synthese viraler RNAs beteiligt sind. Einige dieser neu entdeckten Wechselwirkungen könnten als Angriffsziele für neuartige antivirale Therapien in Frage kommen.
In Zukunft könnte SHIFTR eingesetzt werden, um die Regulation zellulärer Transkriptome, also der Gesamtheit aller RNA-Moleküle einer Zelle, in Gesundheit und Krankheit besser zu verstehen. Dies könnte neue Einblicke in regulatorische Abhängigkeiten und potenzielle Angriffspunkte für Medikamente liefern. Die Plattform ermöglicht es, die Wechselwirkung von RNA-basierten Therapeutika mit der Genexpressionsmaschinerie der Zielzelle genauer zu analysieren. Diese Erkenntnisse könnten als Grundlage für die Entwicklung optimierter RNA-basierter Medikamente, wie beispielsweise mRNA-Impfstoffe, dienen.