Jährlich infizieren sich etwa 10 Millionen Menschen mit Tuberkulose und 1,4 Millionen sterben daran. Damit ist Tuberkulose nicht nur eine der am weitesten verbreiteten, sondern auch die tödlichste Infektionskrankheit. Ähnlich wie Malaria oder HIV ist die Prävalenz von Tuberkulose stark von gesellschaftlichen Faktoren abhängig; sie gilt als klassische Armutskrankheit. Neben mangelnder medizinischer Versorgung stehen der Eindämmung von Tuberkulose weitere Probleme wie Antibiotikaresistenzen und unerwünschte Wechselwirkungen zwischen unterschiedlichen Medikamenten entgegen. Die Abteilung Mikrobielle Naturstoffe des Helmholtz-Instituts für Pharmazeutische Forschung Saarland (HIPS), einem gemeinsamen Standort des Helmholtz-Zentrums für Infektionsforschung (HZI) mit der Universität des Saarlands, sucht in Bodenbakterien nach neuen Wirkstoffen, die diese Probleme lösen sollen. Der jährliche Welttuberkulosetag am 24. März erinnert an die Entdeckung des Erregers Mycobacterium tuberculosis durch Robert Koch an diesem Tag des Jahres 1882.
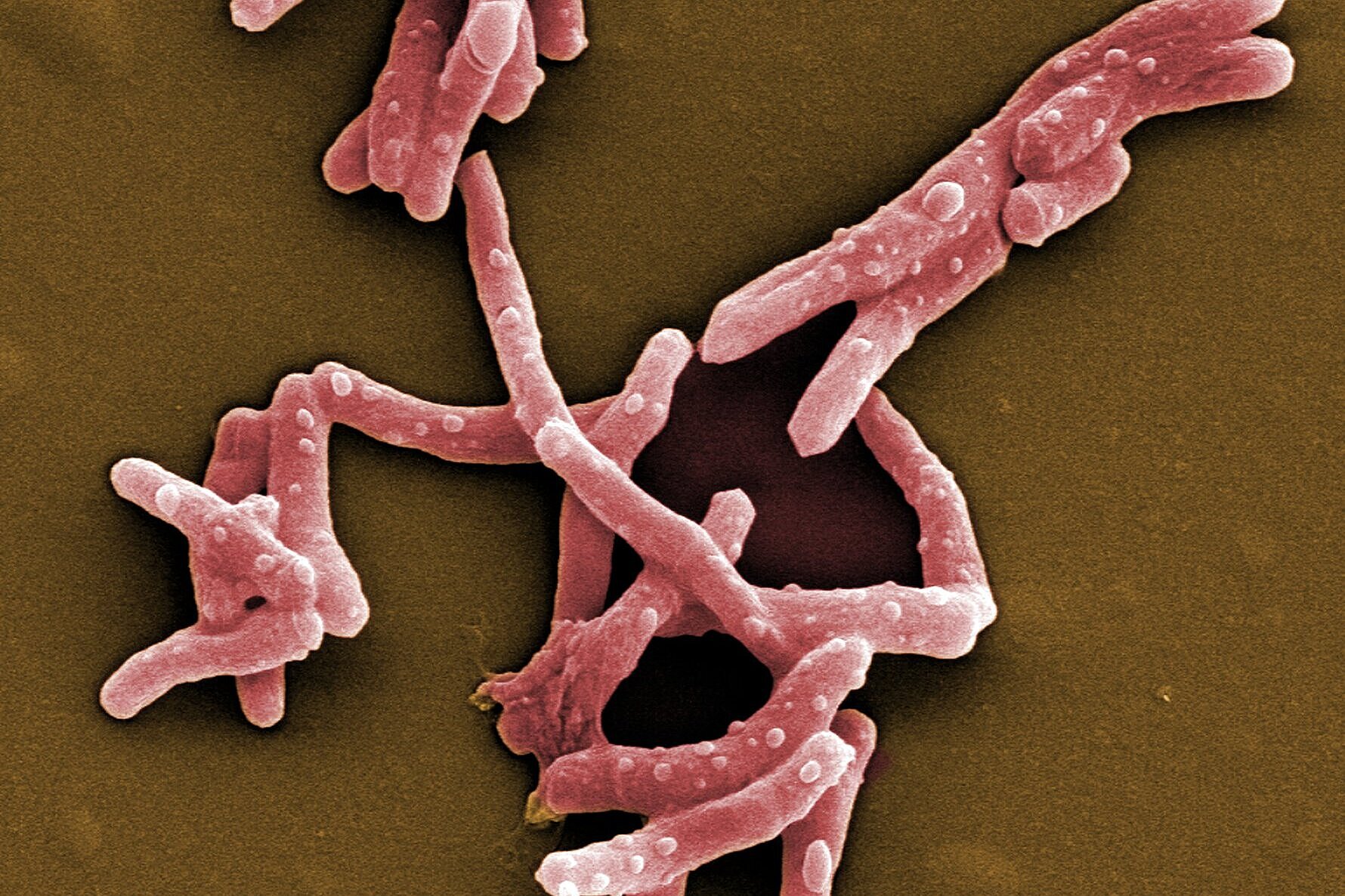
Jennifer Herrmann: Welttuberkulosetag 2021

Tuberkulose ist die Infektionskrankheit, die jährlich die meisten Todesfälle verursacht – in Deutschland bekommt man davon allerdings wenig mit. Woran liegt das?
Obwohl Tuberkulose (Tb) ein weltweites Problem ist, sind Entwicklungsländer in der Regel am härtesten betroffen. Insbesondere Afrika hat mit einer hohen Zahl an aktiven Tb-Fällen und entsprechend hohen Sterberaten zu kämpfen. Tatsächlich ist Europa die Region, in der jährlich die wenigsten Fälle registriert werden. In ganz Europa sind es etwa 300.000 Fälle pro Jahr, weltweit liegt die Zahl der jährlichen Neuinfektionen bei rund 10 Millionen. Gleichzeitig haben wir in Europa allerdings das Problem, dass hier der relative Anteil an multiresistenten Stämmen des Erregers Mycobacterium tuberculosis im weltweiten Vergleich am höchsten ist. In Deutschland bekommen wir davon bisher nicht sehr viel mit; die europäischen Hotspots liegen hauptsächlich in Osteuropa.
Wie entstehen diese Infektionshotspots? Warum ist Tuberkulose so unterschiedlich verbreitet?
Tuberkulose ist eine Lungenkrankheit und wird in der Regel über Tröpfcheninfektion übertragen. Solche Übertragungswege werden begünstigt, wenn Menschen unter unzureichenden Hygienebedingungen oder in sehr gedrängten Verhältnissen leben müssen. Große Ausbrüche gibt es daher beispielsweise in Flüchtlingsunterkünften oder auch in Gefängnissen. Solche Bedingungen in Kombination mit Armut, bei der wiederum das Gesundheitssystem und die medizinische Versorgung nicht immer ausreichend sind, führen zu einer starken Verbreitung von Tb.
Auch andere Erreger können sich unter diesen Bedingungen gut verbreiten. Wie wirkt sich die gleichzeitige Infektion mit anderen Krankheiten auf die Behandlung einer Tuberkulose-Infektion aus?
Eine Koinfektion mit HIV ist wohl das bekannteste Beispiel für einen solchen Fall. Das tritt in der Praxis auch relativ häufig auf, da die Verbreitung dieser beiden Krankheiten regional stark überlappt. Grundsätzlich kann man bei Tb sagen, dass alles, was das Immunsystem schwächt, den Ausbruch der Krankheit und schwere Verläufe begünstigen kann. Dazu zählen auch Zivilisationskrankheiten wie Diabetes. Bei HIV und Tb gibt es noch die sehr ungünstige Wechselwirkung, dass sich die beiden Krankheiten gegenseitig quasi verstärken und die Behandlung zusätzlich erschweren. Schon die standardmäßige Behandlung von Tb dauert mit sechs Monaten sehr lange und kann sich bei Infektionen mit antibiotikaresistenten Erregern sogar über mehrere Jahre erstrecken. Bei Koinfektionen kommen noch sogenannte Drug-Drug-Interactions, also Wechselwirkungen mit anderen Medikamenten, hinzu. Dadurch ist es teilweise sehr schwierig, die Einzeltherapien für verschiedene Infektionskrankheiten optimal aufeinander abzustimmen.
Um diese Probleme zu lösen, forscht die Abteilung Mikrobielle Naturstoffe an neuen Wirkstoffen gegen Tuberkulose-Erreger. Wie geht Ihr dabei vor?
Bevorzugt arbeiten wir an Molekülen, gegen die noch keine Resistenzen bestehen. Das heißt, wenn wir nach neuen Molekülen suchen, testen wir im ersten Schritt zunächst die Wirkung gegen sensitive Bakterien – also solche, die noch keine Antibiotikaresistenzen aufweisen. Anschließend untersuchen wir, ob mit unseren Wirkstoffkandidaten auch das Wachstum resistenter Stämme gehemmt werden kann. Wenn wir hierbei eine komplette Kreuzresistenz finden, d.h. unser neuer Wirkstoff gegenüber multiresistenten Keimen keine Wirksamkeit zeigt, wird es schwierig, diese Substanz weiterzuentwickeln. Manche dieser Moleküle bieten jedoch trotzdem Vorteile gegenüber anderen auf dem Markt erhältlichen Antibiotika. Ein solches Molekül haben wir erst vor Kurzem genauer untersucht: Sorangicin.
Welche Chancen bietet Sorangicin gegenüber anderen Antibiotika?
Wie die meisten unserer Wirkstoffe haben wir Sorangicin aus im Boden lebenden Myxobakterien isoliert. Sein Wirkmechanismus ist fast identisch zu dem eines anderen Antibiotikums, gegen das häufig Resistenzen bei M. tuberculosis beobachtet werden. Sowohl der Naturstoff Sorangicin als auch das First-Line Tb-Medikament Rifampicin inhibieren die RNA-Polymerase und führen so zum Absterben des Erregers. Da wir nicht nur die direkte Wirkung auf Krankheitserreger untersuchen, sondern auch weitere pharmakologische Eigenschaften betrachten, waren wir weiterhin an der Naturstoff-Klasse interessiert. Rifampicin bindet an ein bestimmtes Enzym im menschlichen Körper und beschleunigt dadurch den Abbau von anderen Medikamenten. Bei Sorangicin ist dieser Effekt sehr viel schwächer ausgeprägt. Der Naturstoff könnte somit ein guter Wirkstoffkandidat für die Entwicklung eines Tb-Medikamentes sein, das insbesondere bei Patienten mit Koinfektionen eingesetzt wird, da Sorangicin die Wirkung anderer Medikamente weniger abschwächt. Im Lauf unserer Forschung haben wir außerdem herausgefunden, dass Sorangicin möglicherweise doch effektiv gegen antibiotikaresistente Stämme eingesetzt werden könnte. In nicht-resistenten M. tuberculosis Stämmen zeigen Sorangicin und Rifampicin den gleichen Wirkmechanismus. Wenn eine Rifampicin-Resistenz vorliegt, wird dies durch eine mutierte Bindestelle in der RNA-Polymerase ausgelöst. Spannenderweise kann sich Sorangicin hieran anpassen und es inhibiert auch das mutierte Enzym, allerdings über einen veränderten Mechanismus.
Nach neuen Wirkstoffen gegen Tuberkulose sucht Eure Abteilung aktuell auch im Rahmen eines Kooperationsprojekts mit der Firma Evotec. Worum geht es bei dem Projekt genau?
Konkretes Ziel des Projektes ist es, innerhalb von drei Jahren mindestens eine neue Leitstruktur zu identifizieren und nach pharmakologischen Parametern zu evaluieren. Eine solche Leitstruktur wird dann typischerweise weiter optimiert, um zeitnah in die klinische Testung gehen zu können. Gemeinsam suchen wir Substanzen, die gute Wirksamkeiten gegen M. tuberculosis – auch gegen multiresistente Erreger – aufweisen, eine in vivo-Wirksamkeit gegen Tb zeigen und auch für Menschen gut verträglich sind. Insbesondere die Verträglichkeit ist bei Tb-Medikamenten sehr wichtig, da die Patienten über viele Monate behandelt werden müssen. Idealerweise würden wir einen neuen Wirkstoff finden, der es vielleicht sogar ermöglicht, die Therapiedauer zu verkürzen. Die sehr enge Zusammenarbeit mit der Firma Evotec ermöglicht es, ein solch umfangreiches Projekt erfolgreich zu meistern. Die beteiligten Wissenschaftler des HZI und HIPS bringen insbesondere ihre Expertise ein, was die Auffindung und Produktion neuer Naturstoffe aus Myxobakterien betrifft, wobei Evotec neue Technologien beisteuert. Haben wir einen vielversprechenden Naturstoff charakterisiert, arbeiten wir gemeinsam an der chemisch-synthetischen Optimierung der Naturstoffe, und beide Partner bringen ihre Expertise in der Medizinalchemie ein. Die Ressourcen von Evotec spielen für uns dann vor allem bei der Untersuchung der pharmakologischen Parameter eine Rolle. Wir werden in dieser Phase eher mechanistische Studien beitragen, also feststellen, wo genau in der Zelle die Angriffspunkte für das Antibiotikum liegen.
Weitere Informationen
Interview: Helen Looney
