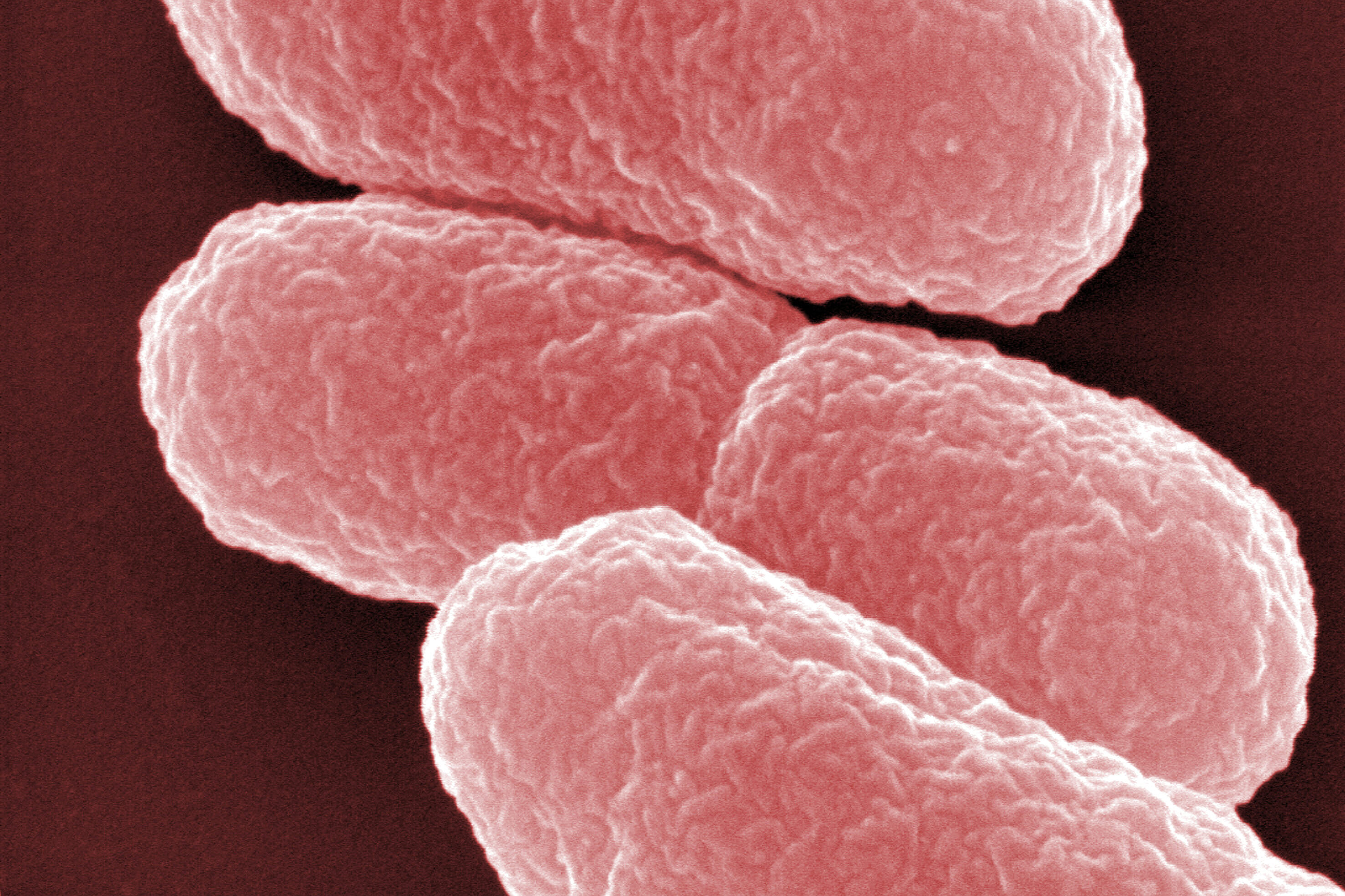
Antibiotika-resistente Bakterien stellen weltweit eine wachsende Bedrohung nicht nur für Infizierte, sondern auch insgesamt für unsere Gesundheitssysteme dar. Insbesondere Infektionen mit dem Bakterium Pseudomonas aeruginosa sind aufgrund zahlreicher Resistenzmechanismen gefürchtet und können gerade bei schwer kranken Patient:innen zu komplizierten Infektionen der Lunge und zu gefährlichen Blutvergiftungen führen. Zudem kann der Erreger dauerhaft Organe wie zum Beispiel die Lunge besiedeln und fördert dort eine fortschreitende Gewebeschädigung. Häufig müssen dann bei infizierten Patient:innen sogenannte Reserveantibiotika verwendet werden, da die Standardtherapien nicht mehr wirken. Neue therapeutische Ansätze werden daher dringend benötigt, um auch zukünftig eine effektive Therapie bei Infektionen mit multiresistenten Erregern wie P. aeruginosa zu gewährleisten.
Forschenden des Deutschen Zentrums für Infektionsforschung (DZIF) und der Universitätsklinik Köln, zusammen mit Kolleg:innen des Helmholtz-Zentrums für Infektionsforschung in Braunschweig sowie des Universitätsklinikums Hamburg-Eppendorf, ist es nun gelungen, aus Immunzellen von Mukoviszidose-Patient:innen, die chronisch mit P. aeruginosa infiziert waren, hochwirksame Antikörper gegen diesen Erreger zu isolieren und zu charakterisieren.
Forschungsansatz aus der Entwicklung antiviraler Therapien
„Viele der hochwirksamen und breit neutralisierenden monoklonalen Antikörper, die gegen Viren zum Einsatz kommen, wurden aus infizierten, genesenen oder geimpften Individuen isoliert und weiterentwickelt,“ erklärt Dr. Alexander Simonis, Erstautor der Studie, Assistenzarzt in der Infektiologie der Klinik I für Innere Medizin und Leiter der BMBF-geförderten Nachwuchsgruppe „Immuntherapien bei bakteriellen Infektionen“ der Uniklinik Köln.
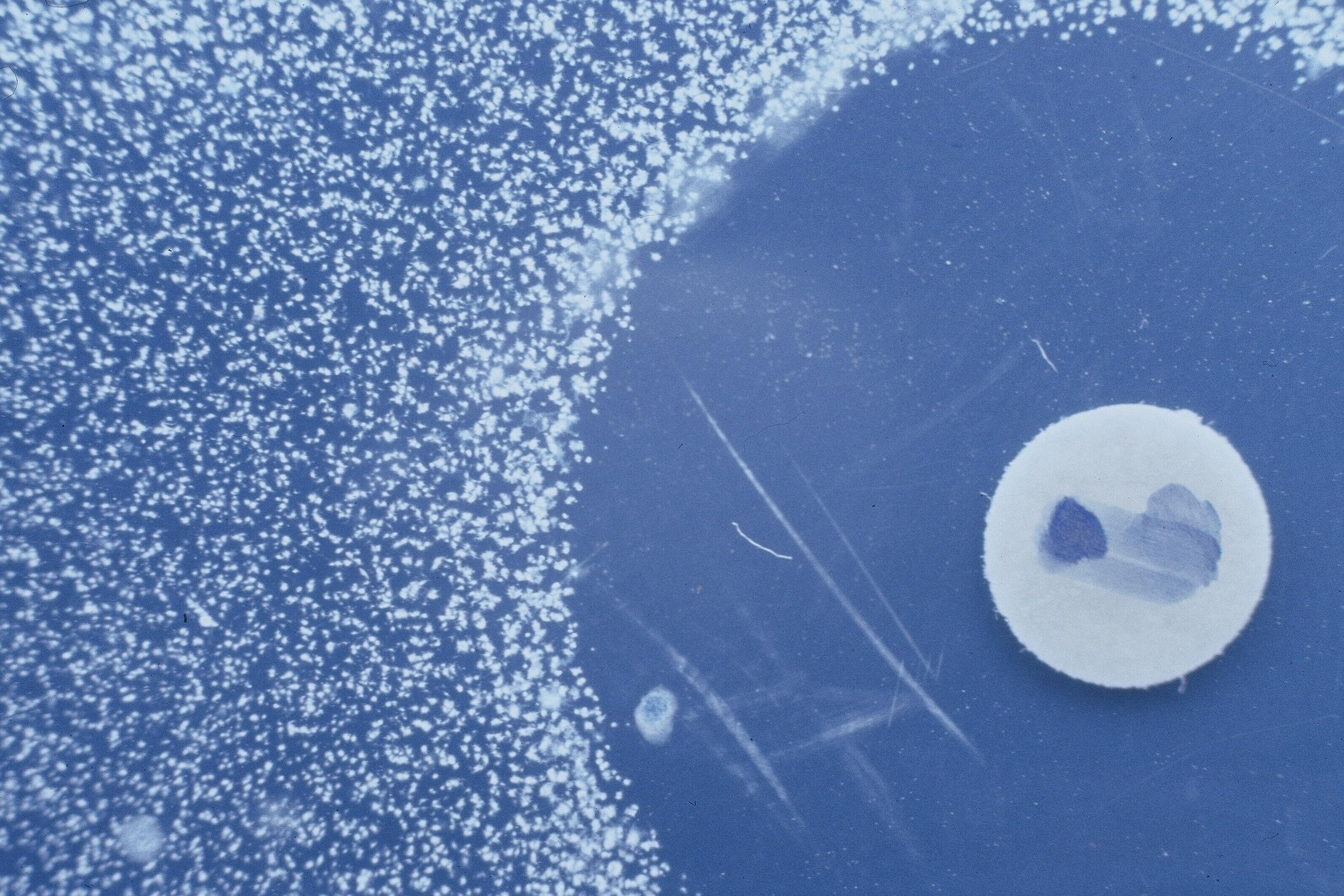
„Gegen bakterielle Infektionen wurden vergleichbare Ansätze kaum genutzt,“ so Simonis weiter. In ihrer Studie untersuchten die Forschenden daher, ob der für virale Infektionen erfolgreiche Ansatz der Isolierung und rekombinanten Expression breit neutralisierender Antikörper aus menschlichen Abwehrzellen auch für die Entwicklung neuer Therapien gegen bakterielle Infektionen angewendet werden kann. Um geeignete Antikörper zu finden, konzentrierten sie sich auf Patient:innen mit Mukoviszidose, deren Lungen oftmals chronisch mit P. aeruginosa besiedelt sind. Die Wissenschaftler:innen gingen dabei von der Hypothese aus, dass eine wiederholte Exposition gegenüber dem Bakterium bei diesen Patient:innen zur Entwicklung von Antikörpern führt, die die Virulenz von P. aeruginosa wirksam hemmen können. Dank eines speziellen Screening-Tests fanden die Forschenden in den Blutproben einiger Mukoviszidose-Patient:innen tatsächlich monoklonale Antikörper, die die Virulenz des Bakteriums neutralisieren können.
Antikörper als Pathoblocker: erfolgreiche Inhibition der bakteriellen Virulenz
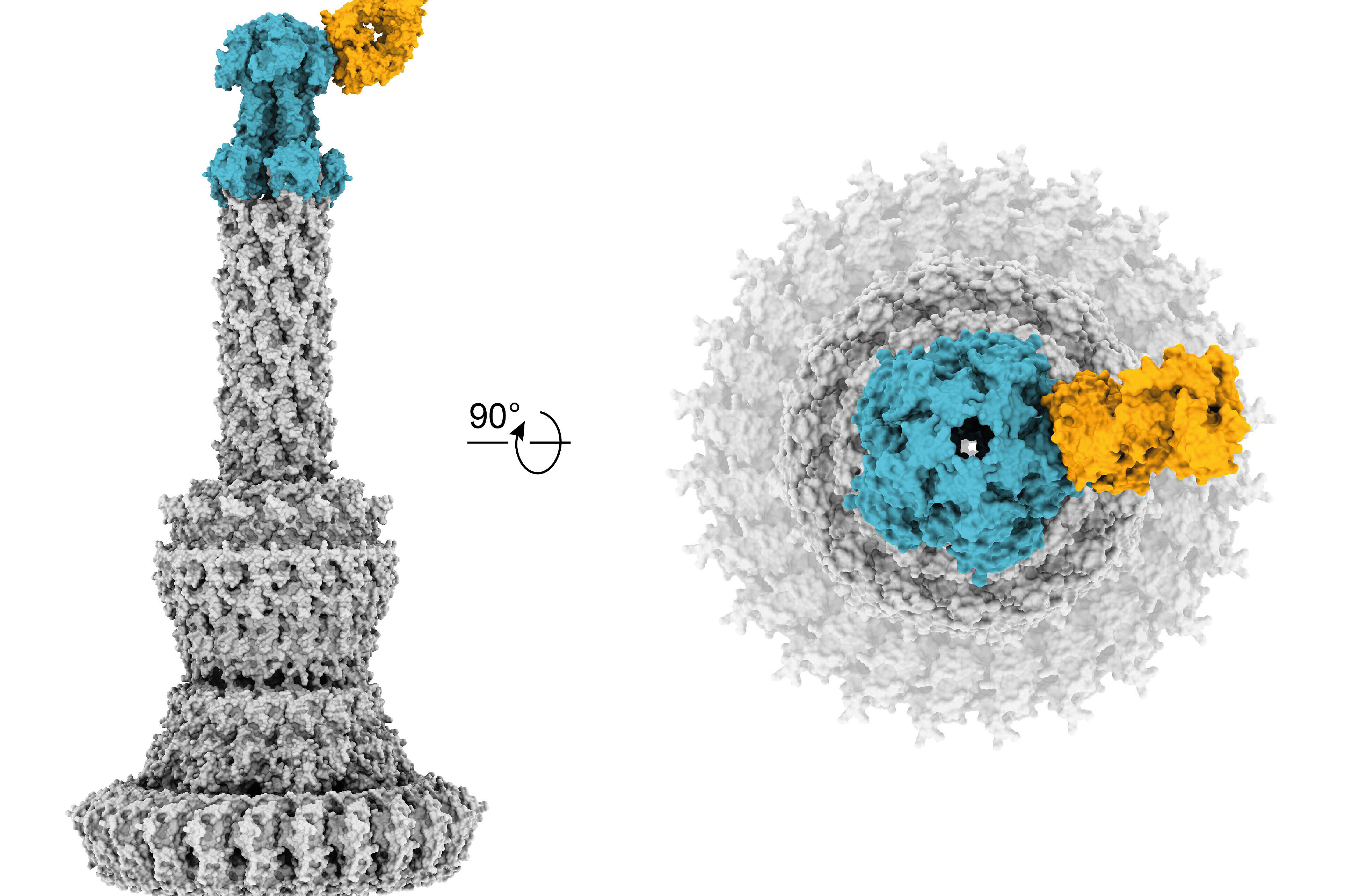
Die Wirkweise dieser Antikörper beruht auf der Blockade eines wichtigen Virulenzfaktors des Bakteriums, dem sogenannten Typ-III-Sekretionssystem, das gerade bei schweren Infektionen mit P. aeruginosa eine wichtige Rolle spielt. In umfangreichen Versuchen in Zellkultur und Tiermodellen konnten die Forschenden zeigen, dass die neu entwickelten Antikörper genauso wirksam gegen das Bakterium sind wie klassische Antibiotika. Da die Aktivität dieser Antikörper aber unabhängig von den Wirk- und Resistenzmechanismen herkömmlicher Antibiotika ist, können diese sogenannten Pathoblocker auch – im Gegensatz zu vielen klassischen Antibiotika – bei hochresistenten Bakterien wirken.
„Die gewonnenen Erkenntnisse und die verwendeten experimentellen Ansätze können auch auf andere bakterielle Krankheitserreger übertragen werden und somit einen vielversprechenden neuen Ansatz zur Therapie von Infektionen mit multiresistenten Bakterien darstellen,“ resümiert der DZIF-Wissenschaftler und Letztautor der Studie, Priv.-Doz. Dr. Jan Rybniker, Oberarzt in der Infektiologie der Klinik I für Innere Medizin und Leiter der „translational research unit – infectious diseases“ an der Uniklinik Köln. „Wir bedanken uns auch insbesondere bei allen Patientinnen und Patienten, die ihr Blut für unsere Untersuchungen zur Verfügung gestellt haben und damit zum Erfolg beitragen konnten“, fügt Rybniker hinzu.
Die Studie basiert auf einer engen Kooperation von Wissenschaftler:innen an mehreren deutschen Forschungsinstitutionen. Relevant für die erfolgreiche Entwicklung der Antikörper war die Zusammenarbeit mit weiteren Forschenden der Uniklinik Köln, darunter insbesondere Dr. Christoph Kreer und Prof. Florian Klein, DZIF-Wissenschaftler und Leiter des Instituts für Virologie der Uniklinik Köln, die ihre Expertise auf dem Gebiet der Antikörperisolation gegen virale Erreger wie HIV-1 und SARS-CoV-2 beitragen konnten. Zudem waren die Leiter des Mukoviszidose Zentrums Köln an der Kinderklinik, Priv. Doz. Dr. Ernst Rietschel und Priv. Doz. Dr. Silke van Koningsbruggen-Rietschel, essentiell für die Gewinnung der Patientenproben. Dr. Katharina Rox, Leiterin der DZIF-Pharmakokinetik/Pharmakodynamik-Einheit am Braunschweiger Helmholtz-Zentrum für Infektionsforschung, konnte zeigen, dass die neuen Antikörper eine sehr gute Wirksamkeit in Tiermodellen aufweisen. Am Zentrum für Strukturelle Systembiologie (CSSB) – eine Kooperation mit dem Universitätsklinikum Hamburg-Eppendorf – entschlüsselten Dr. Biao Yuan und Prof. Thomas Marlovits mit Hilfe der Kryo-Elektronenmikroskopie die genaue Struktur und atomaren Details der Bindungsepitope der neuen Antikörper für das P. aeruginosa-spezifische Zielmolekül.
Die Wissenschaftler:innen planen nun, die in der Studie entwickelten Antikörper gemeinsam mit dem DZIF und Forschungsförderern weiterzuentwickeln und in klinischen Studien zu erproben. Langfristig sollen die Antikörper im Rahmen eines neuen Therapieansatzes insbesondere bei akuten und schweren Infektionen mit P. aeruginosa Anwendung finden. Den Forschenden zufolge bieten die Antikörper darüber hinaus die Möglichkeit, Patient:innen mit einem erhöhten Risiko für P. aeruginosa-Infektionen – vor allem auf Intensivstationen oder bei Krebserkrankungen – mittels einer passiven Immunisierung zu schützen.