Krebserkrankungen gehören zu den häufigsten Todesursachen weltweit und gewinnen in einer immer älter werdenden Gesellschaft zunehmend an Bedeutung. Für viele Tumorarten gibt es jedoch bislang keine befriedigende Therapie. Ein vielversprechender Ansatz ist es, Tumore durch das Immunsystem beseitigen zu lassen. Um das Immunsystem auf Tumore aufmerksam zu machen und eine körpereigene Abwehrreaktion auszulösen, nutzen Wissenschaftler des HZI Bakterien der Art Salmonella enterica. Bei Krebspatienten besiedeln Salmonellen gezielt Tumorgewebe, jedoch kann eine Infektion lebensbedrohlich verlaufen.
Für diese Art der Tumorbekämpfung muss ein Salmonellenstamm zwar eine starke Abwehrreaktion des Immunsystems auslösen, darf dabei aber nicht zu aggressiv sein, um noch in Schach gehalten werden zu können.
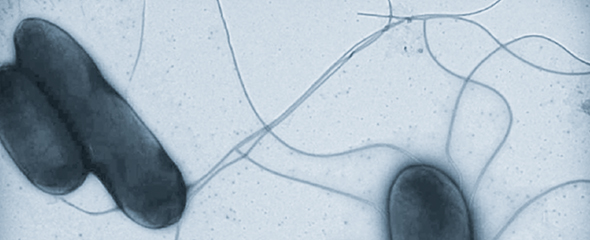
Schritt für Schritt haben die HZI-Forscher die Bakterien genetisch verändert und versucht, eine optimale Balance zwischen Sicherheit und ausreichender Immunantwort zu erreichen. „Wir haben verschiedenste Eigenschaften der Salmonellen verändert, so zum Beispiel einen Baustein, der den Bewegungsapparat ausschaltet und dadurch die Mobilität der Bakterien eingeschränkt“, sagt Felgner.
Um die Sichtbarkeit der Bakterien für das Immunsystem zu erhöhen, haben sich die Wissenschaftler unter anderem bestimmte Proteine in der Membran – also der Außenhülle – der Salmonellen vorgenommen. Dort sind sogenannte Lipopolysaccharide verankert, die aus Zucker- und Fettketten bestehen. Diese Moleküle sitzen an der Oberfläche der Bakterien und werden vom Immunsystem als fremd erkannt. Um sich bei einer Infektion zu verstecken, spalten verschiedene Enzyme der Salmonellen Fettketten ab, sobald sie in einen Wirt eindringen. „Wir haben die Enzyme, die diese Abspaltung vornehmen, in unserem Salmonellenstamm ausgeschaltet. Dadurch bleiben die Fettketten auch im Patienten an der Oberfläche der Bakterien erhalten und sind für das Immunsystem gut sichtbar“, sagt Felgner.
Nach diesem Schema haben die Wissenschaftler verschiedene genetische Veränderungen in ihren Salmonellenstamm eingebracht und die therapeutische Wirkung an Mäusen untersucht. Dabei ist es ihnen auch gelungen, neben der richtigen Balance zwischen der Abschwächung der Bakterien und der Stärke der Immunreaktion eine weitere Hürde zu nehmen: „Ein Problem ist, dass Menschen, die bereits mit den Bakterien in Kontakt gekommen sind, eine Immunität gegen sie entwickelt haben und auf die therapeutischen Salmonellen unter Umständen nicht mehr reagieren“, sagt Prof. Siegfried Weiß, ehemals Leiter der HZI-Abteilung für Molekulare Immunologie und jetzt tätig an der Medizinischen Hochschule Hannover. „Daher muss ein therapeutischer Stamm diesen körpereigenen Schutz überwinden können, denn gerade in Ländern mit schlechten hygienischen Bedingungen sind Salmonelleninfektionen recht häufig und dadurch viele Menschen immun.“ Das Ergebnis der vielfältigen Modifikationen, die die HZI-Forscher vorgenommen haben, ist nun ein Salmonellenstamm, der auch bei Mäusen mit einer Immunität gegen Salmonellen die körpereigene Abwehr mobilisiert. „Selbst Tumore, die bisher resistent gegen den Stamm waren, werden jetzt vom Immunsystem beseitigt“, sagt Weiß.
Die Forschungsarbeiten sind in enger Zusammenarbeit mit der Nachwuchsgruppe „Infektionsbiologie von Salmonellen“ von Prof. Marc Erhardt entstanden, der kürzlich an die Humboldt-Universität zu Berlin gewechselt ist. Der neu entwickelte Salmonellenstamm ist mittlerweile zum Patent eingereicht.
Unser Stamm ist sicher und gleichzeitig effektiv genug für die Tumortherapie. Der nächste Schritt in Richtung therapeutischer Anwendung wäre es nun, den Stamm gemeinsam mit Industriepartnern in klinische Studien zu bringen und seine Eignung für den klinischen Einsatz zu testen.
Originalpublikation:
Sebastian Felgner, Dino Kocijancic, Michael Frahm, Ulrike Heise, Manfred Rohde, Kurt Zimmermann, Christine Falk, Marc Erhardt, and Siegfried Weiss: Engineered Salmonella enterica serovar Typhimurium overcomes limitations of anti-bacterial immunity in bacteria-mediated tumor therapy. OncoImmunology, 2017, <link dx.doi.org/10.1080/2162402X.2017.1382791 _blank link-extern>DOI: 10.1080/2162402X.2017.1382791</link>