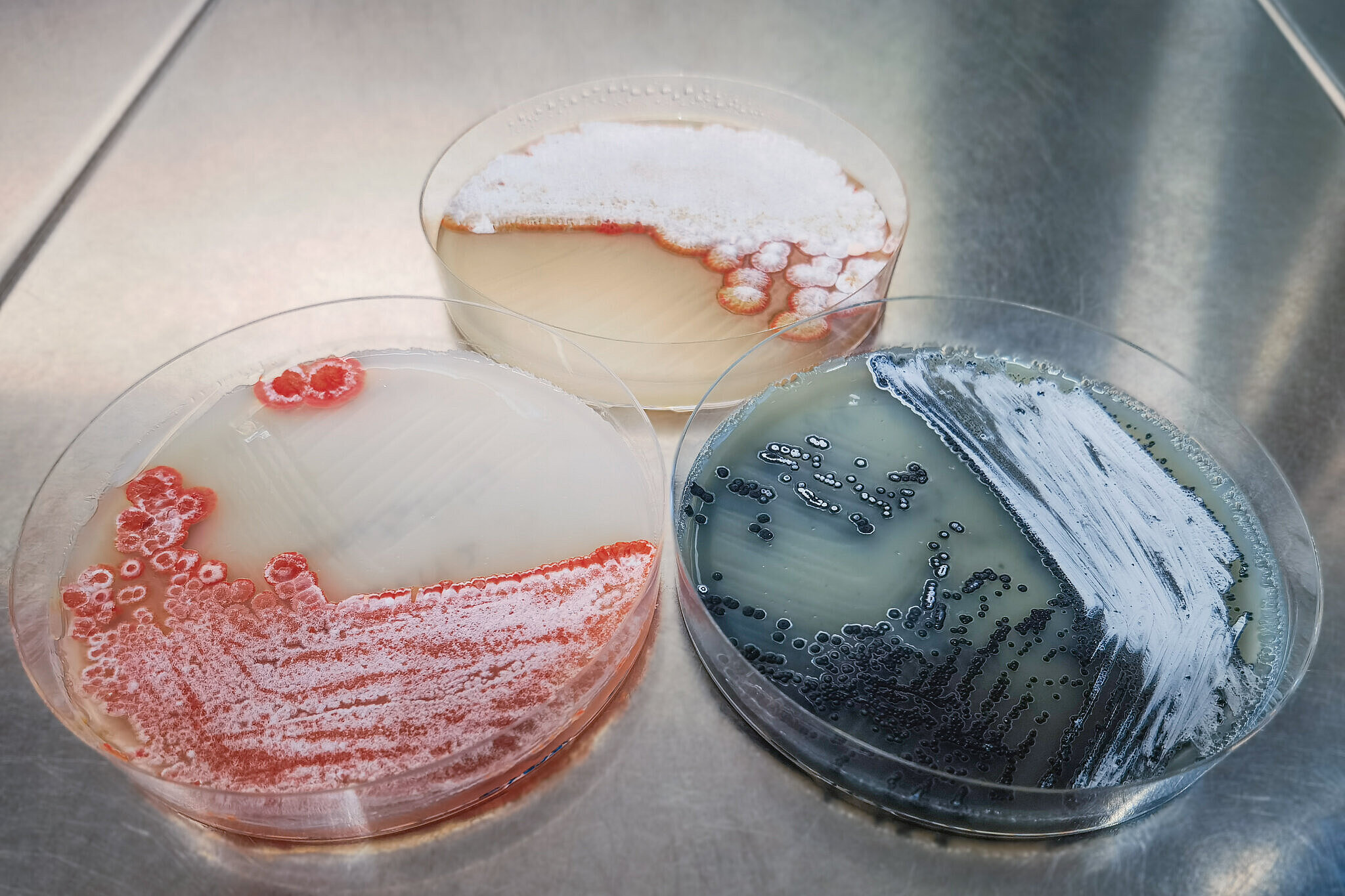
Im Interview berichten drei Forschende des Helmholtz-Zentrums für Infektionsforschung (HZI) und seiner Standorte in Saarbrücken und Greifswald, wie sie die Aspekte dieses Mottos in ihrer Arbeit umsetzen. Dr. Daniel Krug, Wissenschaftler in der Abteilung „Mikrobielle Naturstoffe“ am Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS), einem Standort des HZI in Zusammenarbeit mit der Universität des Saarlandes, sucht im Projekt MICROBELIX gemeinsam mit Bürgerwissenschaftler:innen nach neuen antibiotischen Wirkstoffen und klärt dabei auch die Teilnehmer:innen über AMR auf. Esteban Charria Girón, Doktorand in der HZI-Abteilung „Mikrobielle Wirkstoffe“, untersucht Wirkstoffe aus Pilzen, die im kolumbianischen Regenwald wachsen, und setzt sich für den Erhalt der Biodiversität ein. Prof. Katharina Schaufler, Leiterin der Abteilung „Epidemiologie und Ökologie antimikrobieller Resistenz“ am Helmholtz-Institut für One Health (HIOH), erforscht mit ihrem Team, wie sich resistente Krankheitserreger verbreiten können. Im Gespräch gibt sie zudem Ratschläge, wie jede:r handeln kann, um die Ausbreitung von Antibiotikaresistenzen zu verhindern. Das HIOH ist ein Standort des HZI in Zusammenarbeit mit der Universität Greifswald, der Universitätsmedizin Greifswald und dem Friedrich-Loeffler-Institut.

Weltantibiotikawoche 2024: Educate. Advocate. Act now.
Dr. Daniel Krug: „Educate.“
Mit MICROBELIX kann jede:r zum:zur Forscher:in werden. Erklären Sie uns doch bitte einmal die Idee hinter diesem Citizen Science-Projekt.
MICROBELIX ist eine Einladung an jedermann, mit uns in die Biodiversität der Mikroorganismen im Boden einzutauchen. Damit verbindet sich die Hoffnung, einen Blick auf ansonsten Unsichtbares zu erhaschen, das wir durch unsere Forschungsarbeit sichtbar machen können. Das ganz Kleine unter unseren Füßen ist immer wieder faszinierend für viele.
Dazu kommt natürlich der Anwendungsaspekt, dass eben diese Biodiversität, die wir gemeinsam entdecken, für uns der Input für eine regelrechte Forschungspipeline ist. An deren Ende stehen neue Wirkstoffe. Ich denke, dieses Zusammenspiel von einem allgemeinen Naturforscher-Gedanken und dem Gedanken der medizinischen Anwendung macht den besonderen Reiz dieses Projekts aus.
Neben der Suche nach neuen Wirkstoffen haben Sie mit MICROBELIX ja auch das Ziel, Wissen aktiv in die Gesellschaft zu bringen. Wie klärt das Projekt MICROBELIX die Teilnehmer:innen über die Bedeutung von Mikroorganismen in der Wirkstoffforschung auf, insbesondere in Bezug auf Antibiotika?
Die erste Überraschung, die unsere Citizen Scientists meistens haben, wenn wir unser Projekt vorstellen, ist, dass Antibiotika überhaupt gar keine menschliche Erfindung sind. Stattdessen findet ihr Wirkprinzip gerade im Boden, der ein von Mikroorganismen hoch umkämpftes Habitat ist, regelmäßig Anwendung. Sie tragen mit Antibiotika eine Art fortgeschrittenen Nachbarschaftsstreit aus. Die Myxobakterien, die wir hier in Saarbrücken und in Braunschweig besonders erforschen, müssen als langsam wachsende Organismen chemisch dafür umso schlagkräftiger sein, um sich in diesem Habitat zu behaupten.
Warum ist es aus Ihrer Sicht besonders wichtig, dass die Bevölkerung gerade jetzt mehr über Antibiotika und Antibiotikaresistenzen erfährt, und wie unterstützt MICROBELIX dieses Ziel?
Die Coronavirus-Pandemie hat das Thema der antimikrobiellen Resistenz in den Hintergrund gerückt. Gerade jetzt halten wir es daher für besonders wichtig zu zeigen, dass hier permanent eine Art ‚stille Pandemie‘ unterwegs ist. Wir laufen Gefahr, bei den Antibiotikaresistenzen ins Hintertreffen zu geraten, weil auch die bisherige Praxis der Antibiotikaanwendung inklusive Verwendung in der Tiermast dazu geführt hat, dass wir fortschreitende Resistenzbildungen haben. Wir sind derzeit in der prekären Lage, Innovationen und neue Wirkstoffe hervorbringen zu müssen, weil wir sonst gegen schwer behandelbare Krankheiten keine Reservetherapie mehr haben.
Viele Leute haben bereits einen erfreulich aufgeklärten Wissensstand darüber und sind deswegen mit viel persönlichem Eifer bei MICROBELIX dabei. Auch wenn man erst mal nicht weiß, ob die eigene Bodenprobe nachher die Erfolgsprobe ist, kann man damit aktiv etwas beisteuern.
Esteban Charria Girón: „Advocate.“
Biodiversität und Wirkstoffforschung sind auf den ersten Blick zwei nicht direkt zusammenhängende Themen. Wie setzen Sie sich als Forscher für den Erhalt der Biodiversität ein, und wie hängt dies mit Ihrer Forschung zur Entwicklung neuer antimikrobieller Wirkstoffe zusammen?
Auch wenn diese beiden Themen auf den ersten Blick nichts miteinander zu tun haben, sind Biodiversität und Wirkstoffforschung eng miteinander verknüpft. Die mikrobielle Artenvielfalt ist seit jeher eine wichtige Ressource für die Entdeckung neuer antimikrobieller Wirkstoffe. Ein Teil meiner Forschung konzentriert sich auf die Erforschung mikrobieller Arten, insbesondere von Pilzen, die über Jahrtausende hinweg einzigartige biochemische Mechanismen entwickelt haben, um zu überleben. Durch die Untersuchung dieser Arten und ihrer evolutionären Merkmale wollen wir die mikrobielle Vielfalt in eine chemische Vielfalt umwandeln und so potenzielle neue Antibiotika freisetzen. Dies ist jedoch nur möglich, wenn die biologische Vielfalt erhalten bleibt, was die Dringlichkeit von Schutzmaßnahmen weltweit unterstreicht.
Im Rahmen der Weltantibiotikawoche: Wie trägt der Schutz der Artenvielfalt, insbesondere von Pilzen, zur Lösung der Antibiotikaresistenz-Krise bei?
In meiner Arbeit in der Abteilung „Mikrobielle Wirkstoffe“ (MWIS) konzentriere ich mich auf Pilze, da bestimmte Taxa eine ergiebige Quelle für antimikrobielle Moleküle sind. Trotz der immensen Vielfalt der Pilze haben wir derzeit weltweit nur einen kleinen Teil der Arten identifiziert. Diese Situation ist in den Hotspots der biologischen Vielfalt noch ausgeprägter, z. B. in tropischen Ländern wie Kolumbien, wo ich herkomme. Obwohl diese Regionen über ein enormes Potenzial verfügen, fehlt es ihnen oft an koordinierten Anstrengungen und Infrastrukturen, um ihre biologische Vielfalt vollständig zu erforschen. Durch globale Forschungsexpeditionen sammeln und charakterisieren wir Pilzarten, um neue Antibiotika zu entdecken. Dieser Ansatz, bei dem die biologische Vielfalt im Vordergrund steht, bietet neue Strategien zur Bekämpfung von Antibiotikaresistenzen mit dem Ziel, Lösungen zu finden, die über die Reichweite der derzeitigen Medikamente hinausgehen.
Was motiviert Sie persönlich, sich sowohl in der Forschung als auch öffentlich für die Biodiversität einzusetzen, und warum ist dies für die Antibiotikaforschung so wichtig?
Da ich aus Kolumbien komme, wo der natürliche Reichtum mit Herausforderungen wie dem starken Verlust der biologischen Vielfalt kontrastiert, fühle ich mich verpflichtet, etwas zu unternehmen. Als Forscher:innen leben wir oft in einer Blase, konzentrieren uns auf Laborarbeit oder Analysen und vergessen die Welt jenseits unserer Daten. Ich habe jedoch das Privileg, mit Wissenschaftler:innen zusammenzuarbeiten, deren Verantwortung über Veröffentlichungen hinausgeht, wie z. B. mit meinem Doktorvater Marc Stadler. Als Mitglied von BioGeCo, einem kolumbianisch-deutschen Netzwerk für Wissenschaft und Innovation, und des kolumbianischen Intersektoralen Runden Tischs zur Wissenschaftsdiplomatie (MIDICI) habe ich die Möglichkeit, mich für die biologische Vielfalt einzusetzen, wie ich es kürzlich bei der COP16 in Cali getan habe. Ich vermittle politischen Entscheidungsträger:innen und Interessenvertreter:innen den immensen Wert, den Biodiversität für Entdeckungen, etwa bei der Suche nach Antibiotika, hat. Meine Hoffnung ist, dass wir gemeinsam einen Wandel herbeiführen können – jetzt.
Prof. Katharina Schaufler: „Act now“
Wie tragen Ihre Forschungsansätze dazu bei, die Entstehung und Verbreitung multiresistenter Erreger zu verstehen und zu bekämpfen?
Unsere Forschung analysiert Faktoren, die den Erfolg spezifischer multiresistenter Pathogene begünstigen. Dabei untersuchen wir, welche Gene zur Antibiotikaresistenz, Virulenz und Fitness dieser Erreger beitragen und wie sich ihre Verbreitung in verschiedenen Umgebungen darstellt. Mithilfe von Genomanalysen sowie Laborexperimenten, etwa zur Biofilmbildung und Mortalitätstests in Wachsmottenlarven, gewinnen wir tiefere Einblicke in die Mechanismen, die die Ausbreitung und Widerstandsfähigkeit dieser Erreger fördern. Im Rahmen des Projekts DISPATch_MRGN erforschen wir zudem alternative Therapiestrategien, indem wir neue Angriffspunkte in multiresistenten Erregern identifizieren und Naturstoffe testen, die gezielt wirken, ohne die gesunde Mikroflora zu schädigen.
Die Weltantibiotikawoche sensibilisiert weltweit für den verantwortungsvollen Umgang mit Antibiotika. Was können Bürger:innen im Alltag konkret tun, um die Entstehung und Verbreitung von Antibiotikaresistenzen zu begrenzen?
Der wichtigste Schritt ist zu verstehen, dass jeder dazu beitragen kann, die Ausbreitung von Antibiotikaresistenzen zu verhindern. Antibiotika sollten nur nach ärztlicher Verordnung eingenommen werden und die Dosierung und Einnahmezeitpunkte sollten genau eingehalten werden. Außerdem sollten nicht benötigte Antibiotika auf keinen Fall über die Kanalisation entsorgt werden. Regelmäßiges Händewaschen, Hygiene und ein ausreichender Impfschutz tragen ebenfalls dazu bei, Infektionen zu vermeiden und den Einsatz von Antibiotika zu reduzieren. Sorgfältige Küchenhygiene, insbesondere beim Umgang mit rohem Fleisch, ist ebenfalls ein wichtiger Beitrag zur Reduzierung von Infektionen.
Wie unterstützt der One Health-Ansatz Ihrer Forschung den Schutz von Mensch, Tier und Umwelt vor Antibiotikaresistenzen?
Der One Health-Ansatz integriert die Gesundheitsaspekte von Mensch, Tier und Umwelt, da Antibiotikaresistenzen häufig an den Schnittstellen dieser Bereiche übertragen werden. Im Rahmen des Projekts BALTIC-AMR untersuchen wir beispielsweise die Verbreitung von multiresistenten Bakterien und Antibiotikarückständen in der Ostsee sowie deren potenziellen Einfluss auf Mensch und Tier. Eine kürzlich von uns in npj Clean Water veröffentlichte Studie hat gezeigt, wie resistente Erreger in Gewässern zirkulieren und so das Risiko der Resistenzverbreitung erhöhen können. Solche Forschung hilft uns, die Verbreitungswege und Reservoire von Resistenzen besser zu verstehen und gezielte Maßnahmen zur Eindämmung zu entwickeln, um die Gesundheit von Mensch, Tier und Umwelt nachhaltig zu schützen.